Agronomía Costarricense 49 (2025) 3432

Revisión de literatura
Aspectos geoquímicos de la disponibilidad de cadmio en suelos: conocimiento actual y prospectivas en Costa Rica
Cintya Solano-Solano1, Rolando Castillo-Muñoz2, Juan C. Méndez3/*
*Autor para correspondencia. Correo electrónico: juancarlos.mendez@ucr.ac.cr
1Universidad
de Costa Rica, Programa de Posgrado en Ciencias Agrícolas y Recursos Naturales
(PPCARN) con énfasis en Suelos, Facultad de Ciencias Agroalimentarias, San
José, Costa Rica. ![]() https://orcid.org/0000-0001-8721-6725
https://orcid.org/0000-0001-8721-6725
2Universidad
de Costa Rica, Profesor retirado de la Escuela Centroamericana de Geología, San
José, Costa Rica. ![]() https://orcid.org/0009-0008-2037-8402
https://orcid.org/0009-0008-2037-8402
3Universidad
de Costa Rica, Laboratorio de Suelos y Foliares, Centro de Investigaciones
Agronómicas y Escuela de Agronomía, San José, Costa Rica.
![]() https://orcid.org/0000-0002-1658-400X
https://orcid.org/0000-0002-1658-400X
DOI: https://doi.org/10.15517/qngffe11
Recibido el 04 de marzo del 2025; Aceptado el 05 de agosto del 2025
Resumen
Introducción. El cadmio (Cd) es un metal pesado que representa un riesgo para la calidad ambiental y la salud humana. Su movilidad y disponibilidad en el suelo dependen de procesos geoquímicos cuyo entendimiento es necesario para formular prácticas que mitiguen sus efectos tóxicos. Objetivo. Revisar los principales procesos geoquímicos que controlan la disponibilidad del Cd en suelos, ofrecer un panorama del conocimiento disponible en Costa Rica, e identificar retos analíticos y de investigación a nivel nacional. Metodología. Se realizó una revisión de literatura científica para abordar los objetivos y sintetizar las principales prácticas enfocadas en reducir la toxicidad de Cd en suelos agrícolas. Análisis. El Cd en los suelos tiene origen geogénico o antropogénico. Se encuentra, principalmente, como Cd2+, cuya movilidad, biodisponibilidad y acumulación en cultivos están controladas por procesos geoquímicos como adsorción en coloides minerales y orgánicos, precipitación-solubilización, y formación de complejos solubles. Estos procesos son modulados por propiedades del suelo, principalmente pH, potencial redox y contenido de materia orgánica. Su solubilidad aumenta marcadamente cuando el pH es menor a ~5,5. En Costa Rica, el contenido total de Cd en suelos varía entre < 0,01 y 6,98 mg kg-1, con un promedio de 0,96 mg kg-1, mientras que en sedimentos fluviales se reportan concentraciones menores (promedio 0,13 mg kg-1). Aún no existe información detallada sobre las fracciones geoquímicamente reactivas y biodisponibles de Cd en suelos de Costa Rica. Entre las prácticas más estudiadas para mitigar la disponibilidad de Cd, destacan la aplicación de enmiendas calcáreas y orgánicas, y fertilización con micronutrientes como el Zn. Conclusiones. Es necesario validar metodologías analíticas para caracterizar fracciones reactivas de Cd y su especiación en suelos. Esto permitirá evaluar de manera precisa el riesgo ambiental y formular estrategias para mitigar los efectos adversos del Cd en los cultivos y en la salud humana.
Palabras clave: metales pesados; calidad ambiental; contaminación de suelos; sedimentos fluviales; geoquímica ambiental.
Literature Review
Abstract
Geochemical aspects of cadmium availability in soils: current knowledge and research outlook in Costa Rica
Introduction. Cadmium (Cd) is a heavy metal that poses a risk to environmental quality and human health. Its mobility and availability in soils depend on geochemical processes, whose understanding is essential to develop management practices that mitigate its toxic effects. Objective. To review the geochemical processes controlling Cd availability in soils, to provide an overview of the current knowledge in Costa Rica, and to identify research challenges at the national level. Methodology. A review of scientific literature was conducted to address these objectives, and to identify the most common management practices aimed at reducing Cd toxicity in soils. Analysis. Cd in soils originates from geogenic or anthropogenic sources. It naturally occurs mainly as Cd²⁺, whose mobility, bioavailability, and accumulation in crops are controlled by geochemical processes such as adsorption to mineral and organic colloids, precipitation–dissolution, and formation of soluble complexes. These processes are influenced by soil properties, particularly pH, redox potential, and organic matter content. Cd solubility increases markedly at soil pH values below ~5.5. In Costa Rica, total Cd content in soils ranges from < 0.01 to 6.98 mg kg-1, with an average of 0.96 mg kg-1. Lower concentrations are reported in fluvial sediments (average 0.13 mg kg-1). Detailed information on geochemically reactive and bioavailable Cd fractions in Costa Rican soils is still lacking. The most studied management practices to reduce Cd availability include the application of liming and organic amendments, and fertilization with micronutrients such as Zn. Conclusions. Validation of analytical methodologies for characterizing reactive Cd fractions and its speciation in soils is needed. This is essential for accurate assessments of environmental risk and the development of mitigation strategies to reduce the adverse effects of Cd on crops and human health.
Keywords: heavy metals; environmental quality; soil pollution; fluvial sediments; environmental geochemistry.
Introducción
El cadmio (Cd) es un metal de transición que, junto con otros elementos como níquel (Ni), plomo (Pb), arsénico (As) y cromo (Cr), forma parte del grupo de metales pesados caracterizados por su elevada toxicidad en humanos, animales y cultivos, incluso en concentraciones traza (Alloway 2013, Strawn et al. 2015, Kubier et al. 2019). Dentro de este grupo, el Cd destaca por su alta toxicidad para organismos y movilidad en los ecosistemas (Kubier et al. 2019), así como su tendencia a la bioacumulación. En el ambiente, el Cd se encuentra presente como catión divalente (Cd²⁺), estado en el cual participa en procesos geoquímicos que determinan su especiación, movilidad y biodisponibilidad. El Cd puede formar especies químicas variadas, tales como precipitados con fosfatos, carbonatos y sulfuros (Muehe et al. 2013), o ser retenido en las fases solidas del suelo, particularmente, en las superficies de óxidos metálicos y en la materia orgánica (Weng et al. 2001, Bradl 2004). También, puede encontrarse en solución, ya sea como ion libre (Cd2+(aq)) o en complejos con ligandos inorgánicos (Cl-, NO3-, OH-) y orgánicos (carbono orgánico disuelto) (Sauvé et al. 2000). Entre estas formas, el ion libre Cd2+(aq) es el que está más estrechamente vinculado con la biodisponibilidad de este metal.
El Cd posee una larga vida media biológica, estimada en 15-20 años en humanos y 25-30 años en plantas y animales (Alloway 2013, Genchi et al. 2020). Los efectos tóxicos del Cd fueron reportados por primera vez en Japón durante la década de 1940 (Julia et al. 2024). Desde entonces, una plétora de estudios epidemiológicos ha vinculado la exposición al Cd con tipos específicos de cáncer, osteoporosis y daño renal (Genchi et al. 2020, Jin et al. 2004). Organismos a nivel global como la International Agency for Research in Cancer (IARC), Environmental Protection Agency (EPA) de los Estados Unidos y Swedish National Board of Occupational Health han clasificado el Cd como un elemento altamente cancerígeno (Nordberg et al. 2015, Castillo-Muñoz 2019). La Organización Mundial de la Salud (OMS) ha establecido un límite máximo de ingesta mensual de Cd de 25 µg kg-1 de peso corporal (Kubier et al. 2019).
La principal vía de exposición para los humanos es a través del consumo de alimentos contaminados. A pesar de no ser un elemento esencial, las plantas pueden absorber Cd desde la solución del suelo y acumularlo en sus tejidos (Alloway 2013). Cultivos básicos para la alimentación humana como arroz y papa, producidos en suelos contaminados, han demostrado acumular cantidades importantes de Cd (Wang et al. 2019, Molina-Rocco et al. 2024).
Según la OMS, los alimentos que más contribuyen a la exposición dietética de Cd incluyen arroz, trigo, raíces, tubérculos, vegetales de hoja y moluscos, que representan entre el 40-85% de la exposición total, dependiendo de cada región (WHO 2022). En respuesta a su elevada toxicidad, normativas internacionales han establecido límites para el contenido de Cd en alimentos. Por ejemplo, la regulación de la Unión Europea vigente desde 2019 fija límites máximos de Cd de 0,10 a 0,80 mg kg-1 en productos derivados del cacao (European Food Safety Authority 2012). A raíz de estas regulaciones, se ha hecho evidente la necesidad de investigar los factores que influyen en el comportamiento químico del Cd en suelos, ya que la absorción de Cd por parte de los cultivos está estrechamente relacionada con procesos geoquímicos que determinan la especiación y movilidad de este elemento en el suelo (Vanderschueren et al. 2021).
La identificación de sitos contaminados con Cd y el establecimiento de valores máximos de referencia se basa en la cuantificación del contenido total de Cd en los suelos. A nivel mundial, las concentraciones de fondo de Cd total en suelos oscilan comúnmente entre 0,1 y 1,0 mg kg-1, con un promedio global de 0,36 mg kg-1 (Smolders y Mertens 2013). Concentraciones por encima de 3 mg kg-1 se consideran generalmente como indicación de suelos contaminados. En Costa Rica, para suelos agrícolas se ha definido un valor de intervención de 3 mg kg-1 de Cd total (Ministerio de Salud 2014). Este valor ha sido definido con base en normativas adoptadas en otros países y no necesariamente en información local acerca del contenido natural de Cd en suelos de Costa Rica. Definir un valor de referencia universal para determinar la contaminación por Cd en los suelos es complicado, ya que los niveles naturales de Cd son influenciados altamente por la geología del material parental de cada sitio especifico (McLean y Bledsoe 1992). En Europa, los valores de referencia oscilan entre 0,5 y 5 mg kg-1 según las condiciones del suelo y las regulaciones específicas de cada país (Ballabio et al. 2024).
En lo que respecta al Cd soluble, las concentraciones de este elemento suelen encontrarse en el orden de 5 μg L-1 en la solución de suelo, y alrededor de 1 μg L-1 en aguas subterráneas en sitios no contaminados (Kubier et al. 2019). Estos valores deben interpretarse en relación con los límites de calidad establecidos por distintas agencias internacionales. La OMS recomienda un máximo de referencia de 3 μg L-1 en agua potable, mientras que, tanto la EPA de los Estados Unidos como la Unión Europea (UE), fijan un nivel máximo de 5 μg L-1.
La información sobre la especiación química del Cd en el suelo, es decir, su distribución entre diferentes formas lábiles y no-lábiles, proporciona una perspectiva más precisa sobre su biodisponibilidad en comparación con la sola medición del contenido total (Weng et al. 2001). La especiación química está determinada por procesos geoquímicos fundamentales, como la adsorción-desorción y la precipitación-solubilización, los cuales están estrechamente modulados por propiedades clave del suelo, como el pH, el contenido de materia orgánica y las condiciones redox.
Aunque esta información es esencial para establecer valores de referencia más precisos y diseñar estrategias de mitigación efectivas, en Costa Rica, los pocos estudios existentes se han circunscrito en su mayoría a analizar los contenidos totales de Cd en suelos agrícolas, sin considerar las fracciones químicas que realmente afectan su movilidad y biodisponibilidad (Castillo-Muñoz 2019, Carrillo et al. 2023, Furcal-Beriguete y Torres-Morales 2020, Obando 2021).
En vista del contexto anterior, resulta evidente la importancia de profundizar en el entendimiento de los procesos geoquímicos que modulan la disponibilidad del Cd en suelos y de generar información sobre la especiación química de este elemento en el contexto local. Los objetivos de esta revisión de literatura son i) analizar los principales mecanismos y procesos geoquímicos que controlan la especiación y disponibilidad del Cd en los suelos, ii) ofrecer un panorama actual del estado del conocimiento sobre el Cd en suelos de Costa Rica, y iii) identificar algunos retos en el análisis e investigación para avanzar en el estudio del Cd en suelos y cultivos a nivel nacional. Con esto, se busca sentar las bases para el desarrollo de estrategias de manejo orientadas a mitigar los potenciales efectos negativos de este metal sobre los cultivos, el ambiente y la salud humana.
Origen del cadmio en los suelos
Fuentes geogénicas
El Cd se puede encontrar como elemento traza tanto en rocas ígneas y metamórficas como en rocas sedimentarias, principalmente, en forma de sulfuros polimetálicos, carbonatos, rocas fosfóricas y depósitos arcillosos derivados de sedimentos finos de origen orgánico e inorgánico (Castillo-Muñoz 2019, Kubier et al. 2019, He et al. 2015). El Cd es incorporado a los suelos a partir de la roca madre a través de procesos de meteorización, y el contenido natural está asociado con la composición del material parental del cual se derivan los suelos. Se han reportado concentraciones más elevadas de Cd en rocas sedimentarias (0,01 a 2,6 mg kg-1), en comparación con rocas ígneas y metamórficas (0,07 a 1,0 mg kg-1), especialmente, asociadas a lutitas negras, fosforitas y rocas calcáreas (Kubier et al. 2019, Mar y Okazaki 2012, Hutchinson y Meema 1987, Smolders y Mertens 2013, Liu et al. 2017, Andersson et al. 2014, Quezada-Hinojosa et al. 2009).
En suelos desarrollados sobre lutitas, se han encontrado concentraciones de Cd superiores a 200 mg kg-1 de suelo (He et al. 2015). Un estudio elaborado en Europa con suelos desarrollados a partir de 13 distintos grupos de materiales parentales reportó que los contenidos de Cd más elevados se encontraron sobre materiales parentales ricos en Ca como las calizas (Birke et al. 2017). Esto se atribuye a la sustitución catiónica del Ca2+ por el Cd2+ en las estructuras minerales de rocas carbonatadas (CaCO3), lo cual es facilitado por las similitudes radio iónico y valencia de ambos elementos (Guo et al. 2023).
Este mecanismo de substitución se presenta también en apatitas, donde el Cd2+ puede reemplazar al Ca2+ en su estructura mineral (Liu et al. 2022a).
La principal fuente natural de emisión de Cd hacia la atmósfera son las partículas de suelo, y también puede ser movilizado a través de incendios forestales, sal marina, emisiones volcánicas y polvo meteórico (Kubier et al. 2019, Campos et al. 2016).
Fuentes antropogénicas
Diversas fuentes antropogénicas de contaminación por Cd han sido identificadas, entre las que se encuentran los subproductos de actividades mineras e industriales, desechos municipales, aguas residuales, actividades agrícolas, y cenizas residuales de combustibles fósiles y madera (Alloway y Steinnes 1999). El Cd ha sido utilizado industrialmente en procesos de galvanoplastia, como estabilizador de plásticos, como componente en aleaciones y pigmento en pinturas (UNEP 2010). Desde la década de 1990, la principal aplicación industrial del Cd ha sido la fabricación de baterías de níquel-cadmio (UNEP 2010). Las baterías se han identificado como una de las principales fuentes de contaminación por metales pesados en desechos municipales (Ishchenko 2019). El manejo inadecuado de estos desechos puede provocar la lixiviación y contaminación de Cd en el ambiente, lo que afecta tanto suelos y aguas (Khan et al. 2017).
En Costa Rica, la información sobre fuentes puntuales de contaminación antropogénica con Cd es aún limitada, lo cual resalta la necesidad de generar datos locales. Una fuente potencial de liberación de metales pesados, incluido Cd, es el transporte de lixiviados provenientes de rellenos sanitarios. Por ejemplo, Mora y Mora (2005) reportaron concentraciones elevadas de Zn en sedimentos de la quebrada Azul, influenciada por el drenaje del Relleno Sanitario de Río Azul. Aunque el Cd no fue analizado, las personas autoras sugieren que podría presentar un comportamiento similar al Zn en ese sitio. Este antecedente refuerza la importancia de realizar estudios específicos en áreas de disposición de residuos municipales para evaluar la posible contaminación de suelos, sedimentos y aguas por Cd, y así contar con información que oriente estrategias de monitoreo y gestión ambiental.
Asimismo, una mala gestión de residuos en actividades mineras e industriales puede representar una potencial fuente local de contaminación por Cd en suelos (Kubier et al. 2019). Se han encontrado concentraciones muy elevadas en suelos cercanos a depósitos mineros asociados con menas de sulfuros de Zn y Pb, con valores por encima de 980 mg kg-1 de Cd (Fuge et al. 1993, Peters y Shem 1992). En China, se han encontrado concentraciones elevadas de Cd en depósitos mineros asociados a minas de zinc, plomo, manganeso y estaño (Li 2006, Shi et al. 2022). En Corea del Sur, se determinó que el 21% de suelos cultivables ubicados cerca de zonas mineras e industriales se encuentran contaminados con metales pesados.
El abandono y ausencia de un correcto tratamiento de los relaves en minas inactivas ha permitido por medio de procesos erosivos la dispersión y el transporte de metales pesados como el Cd en zonas arroceras (NIAST 1997, Bolan et al. 2013). La fundición de metales se ha identificado como una fuente importante de emisiones de Cd, principalmente, en ciudades industrializadas (Hiatt y Huff 1975), incluso, se ha considerados como la fuente de contaminación de Cd más importante en algunos suelos de arrozales, especialmente, en China (Bolan et al. 2013). Se han encontrado concentraciones entre 900-1500 mg kg-1 de Cd en suelos cercanos a operaciones de fundición de metales (Peters y Shem 1992).
Los fertilizantes fosfatados también se han identificado como una fuente importante de contaminación difusa de Cd en suelos (Kubier et al. 2019). Este puede encontrarse como impureza en menas de fósforo que contienen minerales como apatita, el cual es el principal constituyente en rocas fosfóricas utilizadas en la producción de fertilizantes fosfatados. Por lo tanto, es posible encontrar trazas de Cd en estos productos fertilizantes (Gnandi y Tobschall 2002, Kubier et al. 2019, Huaraca-Fernández et al. 2020). El contenido de Cd añadido a los suelos mediante el uso de fertilizantes depende de la dosis, la frecuencia de aplicación y el origen de la roca fosfórica del cual se deriva el fertilizante (Grant 2015, He et al. 2015). Se ha reportado que el contenido global de Cd en distintas rocas fosfóricas varía en un rango entre 0,035 – 243 mg kg-1, con un promedio general de 25 mg kg-1 (He et al. 2015). Sin embargo, se han encontrado concentraciones más elevadas de hasta 507 mg kg-1 en algunas rocas fosfóricas de Marruecos (Mar y Okazaki 2012). El contenido de Cd en fertilizantes fosfatados se relaciona con el contenido de P de estos materiales. En Europa, se han reportado contenidos promedio de 30 mg Cd kg-1 P2O5, por debajo del límite máximo establecido por la UE para fertilizantes fosfatados de 60 mg Cd kg-1 P2O5 (Verbeeck et al. 2020).
En Costa Rica, la mayoría de los fertilizantes fosfatados se importa de otros países debido a la ausencia de yacimientos locales de roca fosfórica, lo que hace necesario monitorear su contenido de Cd. De acuerdo con el Decreto N.° 39994 del Ministerio de Agricultura y Ganadería (MAG 2016), el límite máximo permitido de Cd en fertilizantes inorgánicos y enmiendas orgánicas es de 80 mg kg-1 de material.
Procesos geoquímicos del cadmio en los suelos
Adsorción
La adsorción de iones en el suelo es un proceso que ocurre en la interfase sólido-solución mediante el cual diversos compuestos iónicos (adsorbatos) que se encuentran en solución se adhieren a la superficie de las partículas del suelo (adsorbente) en un arreglo bidimensional. La adsorción se distingue de la precipitación superficial en el sentido de que no se desarrolla una nueva fase distintiva en las superficies con disposición molecular tridimensional (Sposito 1987).
La adsorción ocurre a través de dos mecanismos: por atracción electrostática (formación de complejos de esfera externa, intercambio iónico, o fisisorción), o por formación de enlaces covalentes (formación de complejos de esfera interna, intercambio de ligandos o quimisorción) entre adsorbato y adsorbente (Bradl 2004, Strawn et al. 2015). La adsorción de Cd es de gran relevancia tanto en el contexto agrícola como ambiental, ya que es el principal proceso que controla la disponibilidad de Cd para su absorción por los organismos, así como su movilidad en los suelos (Bradl 2004, Loganathan et al. 2012).
Debido a su naturaleza catiónica, la adsorción del Cd se favorece por la presencia de cargas negativas en las superficies de los coloides del suelo. Similar a otros metales pesados, como Pb y Ni, la adsorción de Cd en coloides orgánicos (sustancias húmicas) e inorgánicos (arcillas de filosilicatos y (hydr)óxidos metálicos) es uno de los principales procesos que gobierna su disponibilidad en los suelos (Alloway 2013). La distribución del Cd adsorbido entre estas diferentes fases reactivas varía según la reactividad de dichos coloides y según el contenido total de Cd en el suelo. Mediante una técnica avanzada de espectrometría (NanoSIMS), Schweizer et al. (2024) observaron que el Cd y el Zn se distribuyen en parches irregulares en los microagregados de muestras de suelos expuestas a un gradiente de concentración de estos dos cationes. Inicialmente, la adsorción de Cd ocurrió preferentemente en las fases minerales de óxidos de Fe, pero al aumentar la concentración total de Cd, su localización se extendió progresivamente hacia las arcillas de filosilicatos y la materia orgánica.
Adsorción en (hidr)óxidos metálicos
En suelos, los (hidr)óxidos metálicos (principalmente de Fe, Al, Mn) constituyen una serie de fases minerales con una composición química variada y distintos grados de cristalinidad, que van desde minerales de rango corto de ordenamiento o nanocristalinos (por ejemplo, ferrihidrita) hasta minerales con estructuras cristalinas bien definidas (por ejemplo, goetita y gibbsita). Estos (hidr)óxidos son las principales fases minerales responsables de la adsorción de Cd en el suelo, a través de la formación de complejos de esfera interna (quimisorción) (Wang et al. 2019, Tiberg y Gustafsson 2016, Swedlund et al. 2003, Gräfe et al. 2007). El mecanismo de adsorción predominante involucra la formación de complejos superficiales bidentados, caracterizados por la creación de dos enlaces entre el Cd y los grupos -OH en la superficie mineral, como se ha confirmado mediante estudios espectroscópicos y de modelización de adsorción (Tiberg y Gustafsson 2016, Randall et al. 1999).
Los (hidr)óxidos metálicos poseen propiedades anfóteras en sus superficies reactivas, lo que implica que su carga neta varía en función del pH del medio. A valores de pH por debajo del punto de carga cero (PZC), las superficies de estos minerales presentan carga neta positiva, mientras que a pH superiores al PZC predominan las cargas negativas.
El PZC corresponde al valor de pH en el que las cargas negativas y positivas se equilibran, y su valor es característico de cada fase mineral. Para los (hidr)óxidos de Fe y Al en estado puro, el PZC generalmente oscila entre 7,0 y 9,0 (Qafoku et al. 2004), mientras que en los óxidos de Mn el PZC es más bajo, con valores entre 1,5 y 4,6 (Cornell y Schwertmann 2006). El mecanismo fundamental de generación de estas cargas variables es la protonación y deprotonación de grupos funcionales -OH. Debido al efecto del pH en la generación de cargas, la adsorción de Cd2+ en las superficies de los (hidro)óxidos metálicos incrementa con valores de pH >7. A pH menores, la adsorción de Cd2+ disminuye y, por ende, su solubilidad y disponibilidad aumenta (Alloway 2013).
Además de los efectos del pH, la presencia de compuestos con carácter aniónicos, ya sean orgánicos (ejemplos ácidos húmicos) o inorgánicos (ejemplo fosfato, sulfato), puede favorecer la adsorción del Cd en las superficies de los (hidr)óxidos metálicos. Este fenómeno de adsorción sinérgica ha sido ampliamente documentado (Lamy et al. 1991, Hoins et al. 1993, Davis y Bhatnagar 1995, Collins et al. 1999, Ramstedt et al. 2005, Shirvani et al. 2006, Elzinga y Kretzschmar 2013, Ruyter-Hooley et al. 2016). Por ejemplo, Tiberg y Gustafsson (2016) reportan que la adsorción de Cd en las superficies de ferrihidrita aumenta en presencia de fosfato. Debido a que la adsorción específica de fosfato en las superficies minerales de carga variable incrementa cuando el pH disminuye, el efecto de esta interacción sinérgica de adsorción entre Cd y fosfatos es particularmente importante en condiciones de pH por debajo de ~6,0 y se evidencia como un desplazamiento de los bordes de adsorción de Cd hacia valores de pH más bajos (Tiberg y Gustafsson 2016).
De forma similar, Zhao et al. (2024) analizaron la interacción entre Cd y fosfato en las superficies de goetita (un (hidr)óxido de Fe cristalino) y birnessita (un óxido de Mn) mediante técnicas espectroscópicas y de modelización. Los resultados señalan que el efecto de adsorción sinérgica entre estos iones se debe a una combinación de interacciones electrostáticas, formación de complejos superficiales ternarios y precipitación superficial. El mecanismo predominante depende del tipo de superficie mineral, del pH y de la cantidad total de P y Cd. Este tipo adsorción sinérgica con fosfato tiene implicaciones prácticas en términos de mitigación de disponibilidad de Cd en suelos contaminados (Adhikari y Singh 2008), tal y como se mencionará más adelante.
Por otro lado, la presencia de cationes como Zn2+ y Cu2+, los cuales presentan una mayor afinidad que el Cd2+ por los sitios reactivos de las superficies minerales, puede generar una interacción de adsorción competitiva, lo que a su vez incrementa la solubilidad y disponibilidad del Cd (Loganathan et al. 2012). Este tipo de interacción competitiva entre cationes por los sitios reactivos también puede ocurrir en los sitios reactivos de los coloides orgánicos (Liu et al. 2020) que se detallan a continuación.
Adsorción en coloides orgánicos
Desde un punto de vista químico, la materia orgánica del suelo (MOS) es una compleja mezcla de compuestos con una alta heterogeneidad de grupos funcionales polares, los cuales son responsables de su reactividad frente a compuestos catiónicos (Benedetti et al. 1996). Debido a esta heterogeneidad, la adsorción de metales pesados en la MOS involucra un espectro continuo de interacciones que abarca desde fuerzas coulombianas débiles hasta la formación de enlaces covalentes fuertes. Las cargas negativas de la MOS se generan, principalmente, por la deprotonación de dos tipos de grupos funcionales: los grupos carboxílicos (R-COOH), con constantes de deprotonación (pKa) que oscilan entre ~4,0 y 7,0, y los grupos fenólicos (R-OH), que tienen carácter menos ácido y presentan valores de pKa generalmente superiores a ~8,0 (Strawn et al. 2015, Adusei-Gyamfi et al. 2019). Esto implica que, en condiciones usuales de pH de suelo, los grupos funcionales carboxílicos contribuyen en mayor medida en la generación de cargas negativas en comparación con los grupos fenólicos, y por ende a una mayor adsorción específica de Cd (Bradl 2004). Los metales pesados presentan una alta afinidad intrínseca para adsorberse de forma específica (quimisorción) en estos grupos reactivos de la MOS (Caporale y Violante 2016, Li et al. 2024).
Los coloides orgánicos pueden adsorberse de manera específica en las superficies con carga positiva de los (hidr)óxidos metálicos y así formar asociaciones órgano-minerales estables. Estas asociaciones permiten que los coloides orgánicos actúen como un “puente” entre las superficies minerales cargadas positivamente y los cationes metálicos como el Cd (Arias et al. 2002, Lai et al. 2002, Hizal y Apak 2006, Liu y González 2000). Este mecanismo, contribuye a limitar la movilidad del Cd y a reducir su potencial toxicidad en los sistemas naturales. La interacción es especialmente relevante en condiciones de pH bajo (~4.5–6), donde los (hidr)óxidos metálicos mantienen una carga neta positiva, mientras que los grupos carboxílicos de los coloides orgánicos adquieren carga negativa (Tessier et al. 1996).
Adsorción en arcillas
La interacción del Cd con arcillas de filosilicatos de tipo 2:1, como la illita y arcillas del grupo de las esmectitas, también puede contribuir en la retención de este metal en los suelos. Estas arcillas presentan en sus superficies basales cargas negativas permanentes, las cuales se generan debido a la sustitución isomórfica en sus estructuras minerales. Estas cargas contribuyen a la capacidad de intercambio catiónico de los suelos. El ion Cd²⁺ interactúa con las superficies de los minerales de carga permanente, mediante fisisorción (formación de complejos de esfera externa). En este mecanismo de adsorción, los cationes metálicos retienen su esfera de hidratación completa e interactúan con las cargas superficiales mediante fuerzas electrostáticas débiles.
A diferencia de la quimisorción, los cationes adsorbidos por fisisorción pueden ser reemplazados fácilmente por otros cationes equivalentes en términos de carga, a través de reacciones de intercambio iónico. Por este motivo, la abundancia de cationes como Ca²⁺, Mg²⁺ y K⁺ en el ambiente limita la adsorción de Cd por medio de fisisorción (Smolders y Mertens 2013). La fisisorción de Cd en arcillas de filosilicatos es más relevante bajo condiciones específicas, como por ejemplo altas concentraciones de Cd soluble (O´Connor et al. 1984), o en suelos con bajo contenido de materia orgánica (Weng et al. 2001).
Por otro lado, las zeolitas, tectoaluminosilicatos cristalinos con carga negativa permanente, también pueden adsorber de forma intercambiable cationes metálicos. No obstante, su presencia natural en suelos es limitada (Alloway 2013). Estas zeolitas presentan una estructura única con “cavidades” o “canales” que permiten también la retención específica de ciertos cationes metálicos. Este atributo ha sido ampliamente investigado en estudios de adsorción de metales pesados, incluido el Cd (Fletcher y Townsend 1982, Dixon y Schulze 2002, Ahmed et al. 2009, Őren y Kaya 2006). Debido a estas propiedades, las zeolitas sintéticas se han propuesto como una técnica eficaz para la remediación de metales pesados. Estudios recientes han demostrado su efectividad en la adsorción de Cd, lo que destaca su potencial para aplicaciones ambientales (Santasnachok et al. 2015, Kozera-Sucharda et al. 2020, Peng et al. 2021).
Precipitación
La formación de fases sólidas insolubles en un arreglo tridimensional (precipitación) es otro de los procesos que regula la disponibilidad y movilidad del Cd en los suelos. Este proceso ocurre cuando el producto de actividad iónica (PAI) del Cd y de otros compuestos en solución como carbonatos o fosfatos supera la constante de solubilidad (Ks) de una fase sólida específica, lo que genera condiciones de sobresaturación. La precipitación de fases sólidas que contienen Cd es particularmente relevante en suelos contaminados con altas concentraciones de este metal, como los que se encuentran en áreas industriales o afectadas por actividades mineras. En estos contextos de alta contaminación, la precipitación juega un papel más destacado que la adsorción, pues regula la disponibilidad de Cd en condiciones naturales de suelo (Kubier et al. 2019, Loganathan et al. 2012). La precipitación involucra la formación de sólidos puros, coprecipitación de fases mixtas donde el Cd se incorpora dentro de estructuras cristalinas junto con otros elementos, y precipitación superficial que involucra la formación de fases sólidas distintivas en una interfaz sólido-líquido previamente existente. Sin embargo, en la práctica, es difícil distinguir entre estos mecanismos de precipitación (McLean y Bledso 1992).
En ambientes reductores y en presencia de cantidades significativas de azufre, la precipitación de sulfuro de cadmio (CdS) puede ocurrir debido a la reducción del sulfato (SO42-) a sulfuro (S2-) (Du Laing et al. 2009). La precipitación de fases mixtas de sulfuros de Cd/Zn es más probable que la precipitación de fases puras de CdS (Smolders y Mertens 2013). La fuente de sulfato en el ambiente puede derivarse de las aguas fluviales en ambientes estuarinos o puede ser liberado a partir de la mineralización de la materia orgánica (Du Laing et al. 2007, Neue y Mamaril 1985). Este mecanismo también regula la disponibilidad de Cd y de otros metales como Cu y Zn en ambientes marinos y estuarinos anóxicos (Du Laing et al. 2009).
En suelos calcáreos, donde predominan condiciones alcalinas y altas concentraciones de bicarbonato (HCO₃⁻), el Cd puede participar en procesos de coprecipitación. Debido a la similitud del radio iónico entre Cd2+ y el Ca2+, el Cd puede sustituir fácilmente al Ca en la estructura mineral de los carbonatos de calcio (CaCO3), mediante la reacción:
Cd2+ + CaCO3 → CdCO3(s) + Ca2+ (Ecuación 1)
dando lugar a la formación del mineral otavita (CdCO₃) (Kubier et al. 2019). Por otro lado, en condiciones con elevadas concentraciones de Cd y de fosfato se pueden formar diferentes compuestos como Cd3(PO4)2 y Cd(H2PO4)2 (Lee et al. 2018).
La formación de estas fases minerales que contienen Cd tiene importantes aplicaciones en estrategias de remediación de suelos contaminados. Por ejemplo, Liu et al. (2022b) reportaron que el uso combinado de biocarbón con carbonato de calcio redujo la disponibilidad de Cd y este efecto estuvo mediado por acomplejamiento y coprecipitación de este elemento. La precipitación de carbonatos mediada por microorganismos también ha sido estudiada como técnica de remediación de suelos contaminados con metales pesados. En este proceso no solo se incrementa el pH del suelo, sino que también promueve la coprecipitación de metales como Cd, reduciendo así su movilidad en el medio ambiente (Peng et al. 2021). El uso de fuentes fosfatadas libres de Cd se ha propuesto como otra estrategia de remediación en suelos contaminados con Cd (Mc Gowen et al. 2001) debido a los procesos de adsorción cooperativa y a la precipitación de fosfatos de Cd. Sin embargo, el costo económico de esta alternativa puede limitar en la práctica su implementación.
Formación de complejos solubles
La disponibilidad y movilidad del Cd en los suelos se ve también influenciada por su capacidad para formar complejos solubles, es decir, especies químicas donde el Cd se encuentra unido a ligandos inorgánicos u orgánicos presentes en la solución del suelo. Estos complejos determinan la especiación química del Cd en solución y afectan su interacción con las superficies del suelo y su disponibilidad para las plantas.
Entre los principales ligandos inorgánicos están los aniones cloruro (Cl-), carbonato (CO32-), sulfato (SO42-), mientras que los ligandos orgánicos incluyen diversas fracciones del carbono orgánico disuelto (COD) de bajo y alto peso molecular (Carrillo-Gonzalez et al. 2006, Gardiner 1974, Loganathan et al. 2012, Kubier et al. 2019).
La contribución relativa de estos complejos solubles, es decir la especiación del Cd en la solución del suelo, depende en gran medida de la composición química de la solución del suelo y, particularmente del pH. De acuerdo con Sauvé et al. (2000), a pH ~6,0 predominan los complejos con ligandos orgánicos, mientras que, en condiciones más ácidas aumenta la fracción de Cd2+ como ion libre o acomplejado ligandos inorgánicos. En condiciones más alcalinas, predominan los complejos inorgánicos como Cd(OH)⁺ y los pares iónicos con carbonato.
Los cambios en la especiación del Cd producto de las reacciones de acomplejamiento afectan su carga neta, y, por lo tanto, sus interacciones con las superficies del suelo. Por ejemplo, complejos con menor carga que el ion libre Cd2+ tienen interacciones más débiles con las superficies cargadas negativamente del suelo, lo que puede aumentar su movilidad hacia la rizosfera, haciendo este metal más disponible para la absorción por las plantas. Por otro lado, la interacción de los complejos Cd-materia orgánica con las superficies reactivas de óxidos metálicos puede reducir la movilidad del Cd.
Acomplejamiento inorgánico
Diversos estudios han demostrado que el Cd forma complejos altamente solubles con Cl⁻ como CdCl+ y CdCl20 (Alloway 2013, Ahmed et al. 2009, Rasa et al. 2006, Smolders et al. 1998, Nelson et al. 2009), promoviendo su biodisponibilidad en suelos (Li et al. 1994, McLaughlin et al. 1997). De manera similar, en suelos salinos el sulfato y el Cd pueden formar pares iónicos solubles como CdSO40 y Cd(SO4)22-. No obstante, el efecto de estos pares iónicos en reducir la adsorción de Cd, y subsecuentemente aumentar su disponibilidad, es menos concluyente que en el caso de los complejos con Cl- (Loganathan et al. 2012, McLean y Bledson 1992).
Bajo condiciones reductoras el Cd forma complejos solubles con especies sulfuradas como Cd(HS)0, Cd(HS)3-, Cd(HS)42- y CdHS+ (Kubier et al. 2019, Astruc 1986), lo que regula su especiación en ambientes anóxicos con concentraciones altas de sulfuros. En suelos calcáreos con pH > 8, el Cd puede formar complejos con carbonato y bicarbonato, como CdHCO3-, CdCO30 y Cd(CO3)22-. La solubilidad mínima de la otavita (CdCO3) se alcanza entre pH 9 y 10 antes de aumentar en condiciones más alcalinas debido a la estabilidad del complejo Cd(CO3)22- (Kubier et al. 2019).
Acomplejamiento orgánico
El Cd también forma complejos con compuestos orgánicos en solución, particularmente, con la fracción hidrofílica y de bajo peso molecular de la materia orgánica disuelta (MOD). Aunque estas fracciones de MOD suelen ser menos abundantes que la fracción solida de materia orgánica, estas forman complejos más móviles que pueden favorecer el movimiento de metales pesados en el suelo (Karlsson et al. 2007, Kubier et al. 2019, Kozyatnyk et al. 2016) e incrementar su biodisponibilidad (Sauvé et al. 2000).
A diferencia de otros metales como el Cu y Pb, el Cd forma complejos de menor estabilidad con la materia orgánica, por lo que, comparativamente, su comportamiento es menos afectado por la MOD (McLean y Bledson 1992). Otro mecanismo por el cual la MOD puede contribuir a la movilización del Cd en el suelo es a través de la disolución asistida por ligandos orgánicos de las fases minerales sólidas que contienen Cd adsorbido en sus superficies, particularmente (hidr)óxidos metálicos (Welikala et al. 2021). En condiciones donde la concentración de Cd2+ libre en la solución del suelo es elevada, la formación de complejos Cd-MOD puede contribuir a reducir la disponibilidad inmediata de este metal al transformarlo en especies químicas que no pueden ser bio-asimilables mediante el establecimiento de un equilibrio dinámico Cd2+ ↔ Cd-MOD.
En la Figura 1, se sintetizan los tres principales procesos geoquímicos abordados en este documento (adsorción, precipitación y formación de complejos solubles) que regulan la movilidad y biodisponibilidad del Cd en suelos. Estos procesos son fundamentales para comprender la especiación del Cd en diferentes condiciones edáficas y deben ser considerados al momento de proponer estrategias para mitigar los potenciales efectos tóxicos de este metal en el ambiente y la salud humana.
Variables edáficas que influyen en los procesos geoquímicos del cadmio
En esta sección, se describen las principales variables químicas del suelo que afectan uno o varios de los procesos geoquímicos del Cd abordados previamente. Identificar estas variables y comprender su efecto en la dinámica del Cd en el suelo es clave, ya que las estrategias destinadas a mitigar su disponibilidad deben basarse en un conocimiento detallado de estas propiedades.
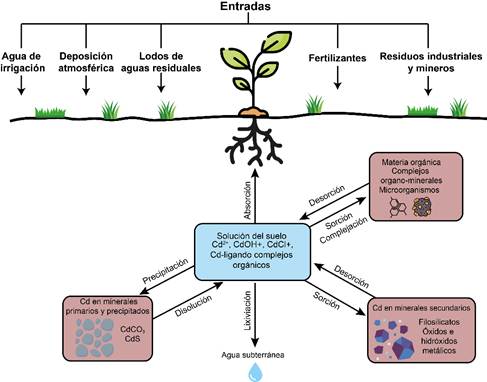
Figura 1. Principales procesos geoquímicos relacionados con la disponibilidad del cadmio en los suelos y posibles fuentes de este elemento, abordados en la presente revisión de literatura.
Figure 1. Main geochemical processes related to cadmium availability in soils and potential sources of this element, as addressed in the present review.
pH de la solución
El pH de la solución del suelo es la propiedad más determinante en la especiación, solubilidad, y biodisponibilidad del Cd, ya que influye directamente en todos los procesos geoquímicos relacionados con la dinámica y especiación de este catión en los suelos. Diversos estudios han confirmado que la disponibilidad del Cd y su acumulación en las plantas son controladas por el pH de la solución del suelo (Kirkham 2006, Smolders y Mertens 2013, He et al. 2015). Por ejemplo, a través de un análisis de regresión multivariado, Argüello et al. (2019) encontraron que la concentración de Cd en granos de cacao está relacionada con el contenido total de Cd, el pH medido en agua (relación 1:5 masa/volumen) y el contenido de carbono orgánico.
Gramlich et al. (2018) reportan que, cuando la concentración de “Cd lábil” no se incluye como variable, el contenido total de Cd y el pH son los mejores predictores de la concentración de Cd en los granos de cacao. Por su lado, Adams et al. (2004) reportan que el contenido total de Cd y el pH del suelo fueron los factores que más influenciaron la concentración de Cd en granos de trigo y cebada. En conjunto, todos estos resultados resaltan la importancia del pH de la solución del suelo en controlar la especiación y la interacción del Cd con otros componentes del suelo.
En general, valores de pH entre ~4,5 – 5,5 favorecen la formación de especies químicas de Cd más móviles y biodisponibles, mientras que valores más neutros o alcalinos promueven un cambio hacia especies de Cd menos biodisponibles (Kirkham 2006, He et al. 2015). La adsorción de Cd aumenta significativamente en valores de pH superiores a 6,0 (He et al. 2015) debido al incremento en la densidad de cargas negativas en las superficies de los minerales de carga variable (por ejemplo, (hidr)óxidos metálicos) y en los coloides orgánicos, lo que favorece la adsorción mediante la formación de complejos de esfera interna (Weng et al. 2001, Tiberg y Gustafsson 2016). Además, valores de pH > 5,5 promueven la precipitación de los iones Al3+ como Al(OH)3(s), reduciendo así la competencia entre Cd2+ y Al3+ por los sitios de adsorción en las superficies minerales (Alloway 2013). En suelos calcáreos, valores de pH > 7,0 favorecen la adsorción del Cd calcita (CaCO3(s)). En suelos con altas concentraciones de Cd, la coprecipitación de CdCO3(s) podría ocurrir a pH > 7,5 (Smolders y Mertens 2013).
El pH del suelo no solo afecta la partición sólido/solución del Cd mediante los mecanismos de adsorción y precipitación analizados anteriormente, sino que también altera la especiación de este metal, tanto en las superficies reactivas como en la solución del suelo. Modelos de especiación geoquímica sugieren que en condiciones de pH menores a 6,5 la mayoría del Cd se adsorbe en la materia orgánica, mientras que los (hidr)óxidos metálicos se convierten en las principales superficies de adsorción a pH > 6,5 (Smolders y Mertens 2013). En cuanto a la fracción soluble de Cd, su especiación también varía en función del pH, lo que afecta la contribución relativa del Cd presente e en solución como ion libre, o acomplejado con ligandos inorgánicos y orgánicos (Sauvé et al. 2000).
Potencial redox en el suelo
El potencial redox (Eh) es un parámetro termodinámico que se relaciona con la capacidad de un sistema para transferir electrones entre especies químicas. Valores altos de Eh indican ambientes oxidantes, mientras que valores bajos señalan ambientes reductores, como ocurre en suelos anegados. Generalmente, suelos con condiciones reductoras presentan Eh entre +100 y -100 mV, mientras que suelos altamente reductores pueden presentar valores entre -100 y -300 mV (Strawn et al. 2015).
El Cd per se no es un elemento sujeto a reacciones redox; sin embargo, su disponibilidad puede verse afectada por cambios en las condiciones redox debido a su acoplamiento con los ciclos de elementos que sí son sensibles a procesos redox como Fe, Mn y S (Kubier y Pichler 2019). Por ejemplo, en suelos aluviales se ha encontrado que fluctuaciones en las concentraciones de Cd están vinculadas a variaciones en Fe, Mn y S disueltos (Kubier et al. 2019).
En condiciones reductoras, la disolución de (hidr)óxidos de Fe y Mn contribuye a la liberación de los elementos que se encuentran adsorbidos en las superficies, incluyendo los metales pesados, lo cual puede incrementar transitoriamente la concentración de Cd en solución, especialmente, en suelos moderadamente ácidos a neutros (Muehe et al. 2013). Además, la liberación de iones Fe2+ y Mn2+ provoca interacciones competitivas con el Cd2+ por los sitios de adsorción en la MOS y en los (hidr)óxidos metálicos remanentes (Alloway 2013).
Sin embargo, en periodos de reducción prolongados, la formación de minerales secundarios de Fe(II) y Fe(II)/Fe(III) como la magnetita y la precipitación de CdS en ambientes sulfurosos contribuyen a la inmovilización del Cd en etapas avanzadas del periodo de reducción (Muehe et al. 2013, Kubier et al. 2019, Wang et al. 2019). El incremento en los valores de pH que usualmente acompaña los periodos de reducción puede potenciar está re-inmovilización. Sin embargo, la formación de CdS puede verse limitada en presencia de metales competidores como Cu, lo que provoca un aumento en la solubilidad del Cd (Fulda et al. 2013).
Por otro lado, durante el proceso de re-oxidación del suelo, el Cd precipitado o adsorbido en la materia orgánica puede liberarse nuevamente debido a la disolución de CdS y a la mineralización de la materia orgánica. Parte de este Cd liberado puede ser adsorbido por (hidr)óxidos metálicos en ambientes oxidantes, aunque una disminución simultánea del pH durante la re-oxidación puede limitar esta retención (Wang et al. 2019).
En síntesis, cambios temporales en las condiciones redox pueden liberar Cd y aumentar su disponibilidad, pero periodos prolongados de reducción/oxidación favorecen la formación de nuevas especies que inmovilizan este metal. Estos procesos son especialmente relevantes en suelos con fluctuaciones constantes en la condición redox, como ocurre en suelos con mal drenaje o en sistemas de arroz inundado.
Contenido de materia orgánica
Después del pH, el contenido de materia orgánica en el suelo es la propiedad química que más se relaciona con la disponibilidad de Cd (Smolders y Mertens 2013). Como se mencionó anteriormente, la materia orgánica contiene grupos funcionales, principalmente, grupos carboxílicos y fenólicos, que le confieren carga neta negativa debido a reacciones de deprotonación. La densidad de esta carga varía en función del pH y del origen de la materia orgánica.
La materia orgánica puede tener un efecto dual en los procesos geoquímicos del Cd, y el impacto final sobre la disponibilidad de este elemento depende del pH del medio. En suelos con niveles naturales de Cd, la materia orgánica puede contribuir a la movilización del metal al liberar carbono orgánico disuelto capaz de formar complejos solubles con el Cd. Por otro lado, en condiciones de pH cercanas a la neutralidad, la materia orgánica tiende a inmovilizar el Cd mediante procesos de adsorción específica, especialmente, en suelos con altos contenidos de materia orgánica (Weng et al. 2001).
Además, la formación de complejos órgano-minerales entre compuestos húmicos y minerales altamente reactivos, como aluminosilicatos de rango corto de ordenamiento, puede favorecer la inmovilización del Cd incluso en suelos con pH relativamente bajos. Arguello et al. (2019) encontraron que la disponibilidad de Cd era menor en suelos derivados de materiales volcánicos (Andisoles) en comparación con suelos derivados de material sedimentario, a pesar de que los Andisoles ricos en materia orgánica presentaban pH generalmente más bajos.
En suelos con altas concentraciones de Cd en solución, la adición de ligandos orgánicos puede disminuir la disponibilidad inmediata de este elemento mediante reacciones de acomplejamiento que reducen la actividad del ion Cd2+. Compuestos orgánicos de bajo peso molecular, exudados por raíces (Zulfiqar et al. 2022) y microrganismos (Shi et al. 2020) desempeñan un papel crucial en este mecanismo de acomplejamiento al mitigar la toxicidad causada por metales pesados.
Fuerza iónica
La fuerza iónica (I, en mol L-1) es una medida de la concentración total de iones en solución, y su valor se relaciona con el grado de interacción entre iones en una solución. Esta propiedad depende de la concentración y de la carga de los iones disueltos, e influye en procesos geoquímicos clave como adsorción de iones, solubilidad de minerales, y especiación química en sistemas acuosos.
El efecto de I sobre la adsorción de Cd en el suelo varía según el pH de la solución y la carga superficial de los coloides. A valores de pH > PZC (carga neta negativa en superficies reactivas), el incremento en I reduce la adsorción de Cd y aumenta su solubilidad.
Por el contrario, a pH < PZC (carga neta positiva en las superficies reactivas), el incremento en I favorece la adsorción de Cd (Naidu et al. 1994), lo cual es consistente con mediciones hechas en sistemas con goetita a pH < PZC (Lutzenkirchen 1997). Convencionalmente, los cambios en adsorción producto de variaciones en I se han asociado con la formación de complejos superficiales de esfera externa (Lutzenkirchen 1997).
Sin embargo, como se abordó previamente, el Cd se adsorbe, principalmente, formando complejos de esfera interna en superficies de (hydr)óxidos metálicos y materia orgánica. El incremento del valor de I puede reducir la adsorción de Cd debido a la formación de pares iónicos como CdCl+1 y CdCl20, los cuales tienen menor afinidad que el Cd2+ por superficies cargadas negativamente (Kubier et al. 2019). Por otro lado, en superficies con carga positiva, estos pares iónicos pueden ser más adsorbidos al incrementar la I debido a la neutralización más efectiva del potencial electrostático que se desarrolla en la interfase sólida-solución.
En suelos con condiciones típicas de pH, en donde pH < PZC y hay dominancia de cargas negativas, un aumento en I puede disminuir la adsorción de Cd en las superficies reactivas del suelo, lo que intensifica su disponibilidad y movilidad en el medio. Estos incrementos en I pueden ser causados por ejemplo por el uso de fertilizantes con alto índice salino o agua de riego con alto contenido de sales.
Contenido de cadmio en suelos y sedimentos de Costa Rica
El estudio del contenido de Cd en los sistemas ambientales (por ejemplo, suelos y sedimentos) de Costa Rica ha sido relativamente limitado, con pocos trabajos disponibles al momento de realizar esta revisión de literatura. La mayoría de los estudios se han realizado de manera localizada, centrados en cultivos de interés agrícola, como banano (Obando 2021) y cacao (Furcal-Beriguete y Torres-Morales 2020, Carrillo et al. 2023). En el caso del cacao, el interés surge a raíz de la normativa de la Unión Europea que regula los niveles máximos permitidos de Cd en productos derivados de este cultivo, lo que ha impulsado estudios sobre su presencia en suelos y tejidos vegetales.
Furcal-Beriguete y Torres-Morales (2020) analizaron concentraciones de Cd en suelos y tejidos vegetales de cacao (raíces, hojas y granos secos no fermentados) de una serie de fincas en dos regiones productoras de Costa Rica: Zona Sur (n = 19) y Zona Norte (n = 21). Los resultados indicaron que la mayoría de las muestras de suelo tenían contenidos totales de Cd por debajo del límite de detección reportado por el laboratorio (< 1 mg kg-1). Únicamente tres muestras de la Zona Sur presentaron concentraciones de Cd de entre 1,3 - 4,0 mg kg-1 (Furcal-Beriguete y Torres-Morales 2020). Respecto a los granos secos, el 33% de las muestras de la Zona Norte tuvieron contenidos de Cd > 1,0 mg kg-1, mientras que en la Zona Sur este porcentaje ascendió al 89%. Estos datos sugieren que las plantaciones de cacao de la Zona Sur tienen una mayor propensión a bioacumular Cd, probablemente, debido a la mayor presencia natural del metal en los suelos, y a las características edáficas y climáticas que facilitan su movilización.
Carrillo et al. (2023) analizaron el contenido de Cd en muestras de suelo y material vegetal de cacao (hojas y granos) provenientes de 150 fincas distribuidas en tres regiones: Brunca (Zona Sur), Huetar Norte, y Huetar Caribe. Los contenidos totales de Cd en los suelos variaron entre < 0,1 y 1,05 mg kg-1, con un promedio de 0,56 mg kg-1. Los autores encontraron que la variabilidad del Cd en los granos estaba explicada, principalmente, (R2 = 0,62) por el contenido total de Cd y el carbono orgánico en los suelos. Aunque el 22% de los granos superó el límite establecido por la Unión Europea (0,8 mg kg-1), los investigadores concluyeron que la contaminación por Cd en los granos de cacao en Costa Rica es menos generalizada que en países como Ecuador, Colombia y Honduras. Se debe anotar que, en los anteriores estudios, se analizó únicamente el contenido total de Cd en suelos, pero no se determinaron otras fracciones más asociadas a la biodisponibilidad de este elemento. A pesar de ellos, los resultados de estos estudios aportan antecedentes valiosos para orientar estudios futuros con un enfoque más detallado.
Por su parte, Obando (2021) analizó la concentración de Cd total y de otros elementos traza (Cr, Ni, Pb, As, Co), así como el contenido extractable de estos con la solución Mehlich 3, en suelos de 10 plantaciones de banano distribuidas en la región Caribe de Costa Rica. Las concentraciones totales de Cd oscilaron entre 0,10 y 1,20 mg kg-1, con un promedio de 0,25 mg kg-1, el cual es inferior al límite de 3 mg kg-1 establecido por el Ministerio de Salud de Costa Rica para suelos contaminados por Cd. En promedio, el Cd extraíble fue 0,10 mg kg-1, es decir en promedio la concentración de Cd extraíble fue 2,5 veces menor que el valor promedio de Cd total. Esto indica la alta solubilidad del Cd en comparación con otros metales traza. Este estudio representa uno de los primeros esfuerzos por evaluar fracciones extractables de Cd en suelos de Costa Rica, más allá de los contenidos totales.
En cuanto al análisis de sedimentos, Calvo-Brenes et al. (2024) analizaron de forma bimensual por un periodo de dos años el contenido total de Cd y otros metales pesados en muestras de sedimentos de ríos provenientes de 26 puntos ubicados en diferentes regiones del país. Se determinó que en ninguno de los sitos de muestreo la concentración de Cd alcanzó el nivel de toxicidad probable (> 0,99 mg kg-1 de sedimento seco). Este nivel de referencia fue definido por los autores basándose en los valores de conceso reportados por MacDonald et al. (2000).
Por otra parte, los estudios realizados por Castillo-Muñoz (2019, 2024) y presentados en el Atlas Geoquímico de Costa Rica (volúmenes 1 y 2) han proporcionado información pionera sobre el contenido total de Cd en suelos (a 50 cm de profundidad) y sedimentos fluviales del país. Estos estudios incluyeron muestreos sistemáticos a nivel nacional y generaron mapas interpolados que muestran las concentraciones totales de Cd en dichos sistemas. El análisis presentado en la siguiente sección se basa en los datos de Castillo-Muñoz (2019, 2024).
Contenido y distribución espacial del cadmio en Costa Rica
Los datos de contenido total de Cd en suelos del estudio de Castillo-Muñoz (2019) se presenta de forma gráfica en la Figura 2. Adicionalmente, en el presente análisis, se incluyeron los datos de contenido de Cd en sedimentos fluviales de Castillo-Muñoz (2024). Estos datos se procesaron con la misma metodología empleada en el Atlas Geoquímico de Costa Rica vol.1 y 2. Para ambos conjuntos de datos, se generaron mapas interpolados con el método Distancia Inversa Ponderada (IDW, por sus siglas en inglés) mediante una escala continua en la cual se muestra el valor de referencia más bajo y el valor más elevado, excluyendo valores atípicos.
En la Tabla 1, se presentan los parámetros estadísticos del contenido total de Cd en suelos y en sedimentos fluviales de Costa Rica, según los estudios de Castillo-Muñoz (2019, 2024). En el caso de los suelos, se reportan valores que oscilan entre un mínimo de < 0,01 mg kg-1, una mediana de 0,90 mg kg-1, un promedio de 0,96 mg kg-1 y un máximo de 6,98 mg kg-1. De acuerdo con el estudio de Castillo-Muñoz (2019), la concentración de fondo geoquímico de Cd total en suelos se encuentra entre 0,58 y 1,30 mg kg-1, mientras que los valores superiores a 2,28 mg kg-1 pueden considerarse atípicos. En cuanto a los sedimentos fluviales, se reportan valores mínimos < 0,10 mg kg-1, una mediana de 0,10 mg kg-1, un promedio de 0,13 mg kg-1 y un máximo de 1,00 mg kg-1. Para sedimentos, la concentracion de fondo geoquímico no está claramente delimitada, ya que el primer y el tercer cuartil, así como la mediana, tienen el mismo valor de 0,10 mg kg-1, equivalente al valor mínimo detectado.
A partir de estos datos, se observa que el contenido total de Cd en los suelos es, en promedio diez veces superior al de los sedimentos fluviales (Tabla 1). Además, el promedio de Cd encontrado por Castillo-Muñoz (2019) para suelos de Costa Rica (0,96 mg kg-1) es superior al promedio global (0,36 mg kg-1) reportado por Kubier et al. (2019). Por otro lado, las concentraciones de Cd en sedimentos se encuentran por debajo del valor de referencia propuesto por MacDonald et al. (2000), bajo el cual es poco probable que ocurran efectos tóxicos por Cd ecosistemas de agua dulce.
En los mapas interpolados de contenido total de Cd en suelos y sedimentos (Figura 2), las tonalidades rojizas representan las concentraciones más elevadas, mientras que las azules representan las concentraciones más bajas. En el caso de los suelos (Figura 2A), las áreas con mayores concentraciones de Cd total se ubican principalmente en el Pacífico Sur y Caribe Sur, en parte del Pacífico Central, en algunos cantones del Gran Área Metropolitana (GAM) de San José, en la Zona de los Santos, y en la provincia de Guanacaste cerca de la desembocadura del río Tempisque.
En cuanto a los sedimentos fluviales (Figura 2B), las concentraciones más elevadas se localizan en las regiones del Pacifico Central y Sur, más que todo en el valle de El General y la Cordillera Costeña, así como en zonas específicas del Caribe, al suroeste de la ciudad de Limón, en la parte centro-occidental del GAM, en el sur de la península de Nicoya (particularmente, en la cuenca baja de los ríos Tempisque y Bebedero), y al suroeste del volcán Miravalles (Castillo-Muñoz 2024). Al comparar los mapas de distribución de Cd en suelos y sedimentos fluviales, se identifican zonas de coincidencia en patrones de altas concentraciones, especialmente, en el Pacífico Sur y Central, la cuenca baja del río Tempisque, la parte occidental del GAM y el suroeste de la ciudad de Limón (Castillo-Muñoz 2024).
La detección de niveles relativamente elevados de Cd en los suelos de estas regiones resalta la necesidad monitorear constantemente el contenido de este metal en los productos generados a partir de las actividades agrícolas y ganaderas de dichas regiones, y así de ser necesario implementar prácticas de manejo que reduzcan la disponibilidad de Cd e impidan su incorporación en la cadena trófica. Cultivos como arroz y cacao, que se ha demostrado pueden acumular Cd en las partes cosechables (Yu et al. 2020, Vanderschueren et al. 2021), requieren especial atención. Asimismo, se ha documentado la acumulación de Cd en órganos y vísceras de bovinos, particularmente, en el hígado destinado al consumo humano (Lopéz-Alonso et al. 2000). Al respecto, en un estudio realizado con muestras de hígado bovino (n = 60) destinadas para consumo humano en el área metropolitana de Costa Rica se encontró que el Cd fue el metal pesado detectado en mayor concentración, con un valor máximo de 364,3 µg kg-1 y un promedio de 82,2 µg kg-1 (Rodríguez 2014). No obstante, estos valores se encuentran por debajo del límite máximo permitido de 500 µg kg-1, establecido en la normativa de la Unión Europea, utilizada en dicho estudio como referencia.
En las zonas con mayores concentraciones de Cd total, es previsible que suelos con pH inferior a 5,5 y sometidos a condiciones de alta precipitación favorezcan la solubilidad y movilidad de este elemento, aumentando así su disponibilidad para los cultivos. No obstante, se requieren estudios más específicos que permitan establecer correlaciones sólidas mediante la determinación de fracciones geoquímicamente activas de Cd, así como la evaluación de otras propiedades del suelo como pH, contenido de materia orgánica y minerales reactivos que influyen directamente en la especiación y movilidad del Cd.
Debido a que los datos disponibles actualmente corresponden únicamente al contenido total de Cd, no es posible establecer conclusiones acerca de sus diversas fracciones geoquímicas. Como se discutió previamente, en los suelos el Cd puede encontrarse adsorbido a coloides minerales u orgánicos, estar precipitado en diversas fases minerales, o formar complejos solubles en la solución del suelo. Para comprender mejor el origen de los patrones espaciales observados y el potencial efecto en los ecosistemas, será beneficioso contar con estudios más detallados que permitan identificar las fracciones específicas de Cd que se asocien más directamente con su disponibilidad.
No obstante, con base en la información disponible, se puede inferir que, en zonas como la Cordillera Costeña del Pacífico Sur, las altas concentraciones de Cd podrían estar relacionadas con la presencia de rocas sedimentarias carbonatadas, dado que este metal puede sustituir cationes divalentes como Ca2+ en la estructura cristalina del CaCO3, debido a la similitud en radio iónico entre ambos elementos (Kubier et al. 2019). Por otro lado, las concentraciones elevadas de Cd cercanas al GAM podrían reflejar una influencia antropogénica.
A pesar de que la densidad de muestreo es relativamente baja y solo se reportan datos del contenido total de Cd, los estudios de Castillo-Muñoz (2019, 2024) son fundamentales para identificar áreas prioritarias de interés para realizar estudios futuros. Idealmente, estos estudios deberían incluir la cuantificación de diferentes fracciones de Cd y la evaluación de variables edáficas (por ejemplo, pH, contenido de carbono orgánico, mineralogía) que afectan su movilidad y biodisponibilidad en el ambiente.
Tabla 1. Resumen estadístico del contenido total de cadmio en suelos (Castillo-Muñoz 2019) y sedimentos fluviales (Castillo-Muñoz 2024) de Costa Rica.
Table 1. Statistical summary of total cadmium content in soils (Castillo-Muñoz 2019) and fluvial sediments (Castillo-Muñoz 2024) from Costa Rica.
|
Nº muestras |
Mínimo |
1er cuartil |
Mediana |
3er cuartil |
Máximo |
Promedio |
DE |
|
Cd en suelos (mg kg-1) |
|||||||
|
545 |
< 0,01 |
0,58 |
0,90 |
1,30 |
6,98 |
0,96 |
0,61 |
|
Cd en sedimentos fluviales (mg kg-1) |
|||||||
|
419 |
< 0,10 |
0,10 |
0,10 |
0,10 |
1,00 |
0,13 |
0,07 |
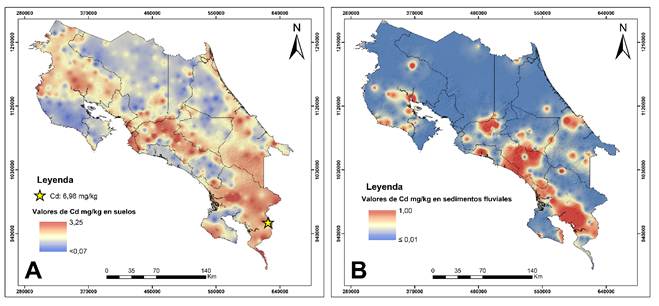
Figura 2. Panel A: mapa interpolado del contenido de cadmio total (mg kg-1) en suelos de Costa Rica (Castillo-Muñoz 2019). Panel B: mapa interpolado del contenido de cadmio total (mg kg-1) en sedimentos fluviales de Costa Rica (Castillo-Muñoz 2024).
Figure 2. Panel A: Interpolated map of total cadmium content in soils from Costa Rica (Castillo-Muñoz 2019). Panel B: Interpolated map of total cadmium content in fluvial sediments from Costa Rica (Castillo-Muñoz 2024)
Estrategias de mitigación de la disponibilidad de Cd en suelos
Como se discutió anteriormente, el pH es un factor determinante en la solubilidad del Cd en los suelos. La práctica de encalado es utilizada en la agricultura en parte para prevenir la toxicidad por aluminio en suelos ácidos, no obstante, dicha práctica también permite mitigar la toxicidad por metales pesados (Smolders y Mertens 2013). Al incrementar el pH, la adsorción específica de Cd en minerales de carga variable es incrementa. Por ejemplo, en (hidr)óxidos de hierro, valores de pH por arriba de 6,0 favorecen la adsorción específica del Cd en sus superficies reactivas (Smolders y Mertens 2013).
Diversos estudios han demostrado la eficacia de la técnica del encalado aplicado a distintos cultivos que han evidenciado tener problemas de bioacumulación de Cd, como trigo, cacao y arroz (Ciecko et al. 2001, Tlustoš et al. 2006, Engbersen et al. 2019). En arroz, por ejemplo, se han reportado reducciones en la concentración de Cd en granos de entre un 24 y 49%, dependiendo de la dosis aplicada (Kong et al. 2021, Liao et al. 2021, Zhu et al. 2016, Liu et al. 2020). La eficiencia del encalado también depende de diversos factores como el tipo de material utilizado para encalar, el pH del suelo, el contenido de materia orgánica, la capacidad de intercambio catiónico y el contenido de arcilla (He et al. 2021, Yang et al. 2018).
Al implementar el encalado como estrategia para mitigar la disponibilidad de Cd, es fundamental evitar sobredosificaciones, ya que un exceso de cal puede reducir la disponibilidad de nutrientes esenciales como fósforo y boro. Se ha sugerido que, en suelos dominados por minerales de carga variable, no se debería elevar el pH por medio de encalado a valores por encima de 6,0 para prevenir efectos negativos sobre el rendimiento de los cultivos (Sanchez 2019). Por lo tanto, resulta clave encontrar un equilibrio entre disminuir la disponibilidad de Cd y mantener la de nutrientes esenciales, lo cual podría lograrse mediante la combinación con otras estrategias de manejo, como las que se detallan a continuación.
El uso de enmiendas orgánicas como el compost y biocarbón ha sido también propuesto para para reducir la movilidad de diversos contaminantes, tanto orgánicos como inorgánicos (Sohi et al. 2010, Agegnehu et al. 2017). La efectividad de las enmiendas orgánicas en la inmovilización de metales radica en la fracción coloidal húmica, los cuales pueden reducir la movilidad de contaminantes como el Cd mediante los mecanismos de adsorción específica (Smolders y Mertens 2013). Modelos geoquímicos de especiación han demostrado que, en suelos con pH < 6,5, la mayoría del Cd está ligado a la materia orgánica, en suelos con pH mayor a 6,5, la adsorción de Cd se da, principalmente, en (hydr)óxidos de Fe (Buekers et al. 2008). El uso de estiércol de animales ha demostrado ser efectivo en la inmovilización de Cd en los suelos y es una de las enmiendas orgánicas más utilizadas (Khan et al. 2017, Burton y Turner 2003). Un estudio de Huang et al. (2018) encontró que el uso de tratamientos de estiércol de cerdos y gallinas en cultivos de arroz redujo significativamente la fracción de Cd extraíble e intercambiable en el suelo. Asimismo, el uso de enmiendas orgánicas, en combinación con otros métodos como el encalado y la aplicación de óxidos de hierro, ha demostrado ser eficaz en la reducción de la disponibilidad de metales en los suelos (Ciecko et al. 2001, Zaniewicz-Bajkowska et al. 2007, Diagboya et al. 2015).
La fertilización con micronutrientes también se ha propuesto como un método que puede ayudar a prevenir la absorción de Cd por los cultivos (Sarwar et al. 2010, Köleli et al. 2004). El Cd no es un elemento esencial para las plantas, ya que no tiene una función fisiológica conocida, sin embargo, puede ser fácilmente bioacumulable cuando se encuentra disponible en los suelos (Smolders y Mertens 2013). La bioacumulación de Cd en las plantas depende de la disponibilidad de dicho elemento en los suelos y su interacción con otros elementos químicos. Por ejemplo, se ha encontrado que el Zn es el competidor más eficiente del Cd por los sitios de adsorción, debido a que tienen un comportamiento geoquímico similar (Subašić et al. 2022). La deficiencia de micronutrientes metálicos en los suelos como el Zn y el Fe puede favorecer la bioacumulación de Cd en las plantas (McKenna et al. 1993, Astolfi et al. 2012). En condiciones de deficiencia de estos micronutrientes, los transportadores de metales en las membranas celulares de las plantas también pueden transportar elementos tóxicos como el Cd que comparte similitudes en tamaño y valencia (Huang et al. 2024).
Por ejemplo, en plantas de arroz y de Arabidopsis se ha reportado que los transportadores de Zn, Fe y Mn pueden participar también en el transporte del Cd (Ishikawa et al. 2012, Sasaki et al. 2012, Vert et al. 2002, Thomine et al. 2000). Por lo tanto, mantener una nutrición adecuada en los cultivos puede ayudar a evitar una potencial toxicidad por Cd.
Otra técnica de remediación utilizada en suelos con niveles moderados de contaminación es la fitorremediación. Esta técnica utiliza plantas in situ que se caracterizan por hiperacumular metales pesados disponibles en los suelos (He et al. 2015, Mench et al. 2010). A pesar de ser un elemento altamente tóxico, el Cd no parece causar daño a las plantas hiperacumuladoras. Dentro de los diversos mecanismos de fitoremediación, la fitoestabilización y fitoextracción son dos de los mecanismos más empleados en suelos contaminados con Cd (Subašić et al. 2022, Ashraf et al. 2019, Arthur et al. 2005).
La fitoestabilización se da cuando la planta a través de sus raíces fija el metal reduciendo su movilidad y biodisponibilidad en el suelo (Wuana y Okieimen 2011). En el caso del Cd, se han encontrado plantas estabilizadoras pertenecientes a las familias de las brasicáceas (ejemplo Sinapis alba); de las poáceas (ejemplo Miscanthus x giganteus), y de las miristicáceas (ejemplo Virola surinamensis) (Subašić et al. 2022, Zgorelec et al. 2020, Boros-Lajszner et al. 2020).
Por su parte, la fitoextracción o fitoacumulación es una técnica utilizada para remoción de metales pesados mediante el uso de plantas hiperacumuladoras que absorben, translocan y acumulan los metales en sus tejidos vegetales (Subašić et al. 2022). En el caso del Cd, se consideran hiperacumuladoras aquellas plantas que acumulan más de 100 mg kg-1 de Cd (van der Ent et al. 2013). Se han identificado varias plantas hiperacumuladoras de Cd como por ejemplo Solanum nigrum L. (Sun et al. 2006), Sedum alfredi (Ni y Wei 2003), Youngia erythrocarpa (Lin et al. 2014), Nicotiana tabacum (Liu et al. 2011), Thlaspi caerulescens (Boominathan y Doran 2003), Celosia argentea (Yu et al. 2020), Cassia alata (Silva et al. 2018), y Swietenia macrophylla (Fan et al. 2011).
Retos de investigación y oportunidades
Tras un análisis detallado de los principales procesos geoquímicos y propiedades edáficas que regulan la disponibilidad de Cd en los suelos, y del estado actual del conocimiento en sistemas ambientales de Costa Rica, en esta se sección se enumeran algunos de los principales desafíos y oportunidades de investigación identificados a partir de esta revisión. Como se ha mencionado, la presencia de Cd en los suelos representa un problema ambiental y agrícola con implicaciones en la calidad del suelo, la productividad de los cultivos y la salud humana. La bioacumulación de Cd en materiales vegetales puede también tener implicaciones económicas y sociales, particularmente, en productos de exportación como el cacao, ya que la concentración máxima permitida de este metal se encuentra regulada en normativas internacionales.
Es fundamental profundizar en la investigación sobre los factores que controlan la movilidad y biodisponibilidad del Cd en suelos costarricenses, con el fin de desarrollar estrategias efectivas de monitoreo y manejo agronómico basadas en el entendimiento de los procesos fundamentales que regulan su dinámica en el ambiente.
Uno de los principales retos en la investigación futura es la caracterización de procesos y variables geoquímicos que determinan la movilidad y disponibilidad del Cd en suelos. La sola cuantificación del contenido total de Cd en el suelo no es un buen predictor de su biodisponibilidad ni de los riesgos potenciales que este elemento representa (Smolders y Marteen 2013, Qin et al. 2024). Por ello, algunos países han definido límites de intervención diferenciados en función de propiedades específicas del suelo. Por ejemplo, en China la normativa ajusta los límites en función del pH, estableciendo un umbral de 0,3 mg kg-1 para suelos con pH < 5,5 (Wu et al. 2021). La implementación de límites de intervención diferenciados para Cd en diferentes condiciones edáficas y climáticas de Costa Rica requeriría estudios detallados para definir las concentraciones geoquímicas de fondo según la geología y génesis de los suelos, así como el considerar el efecto de variables edáficas (incluyendo pH, contenido materia orgánica, y mineralogía dominante) y climáticas (precipitación, temperatura).
En la literatura, no se ha definido un índice universal de disponibilidad del Cd en suelos (Sauvé et al. 2000). Sin embargo, diversas metodologías de extracción química han sido propuestas para estimar fracciones específicas del Cd relacionadas con su reactividad y biodisponibilidad en plantas y microorganismos del suelo. Entre estas, destaca la extracción con una solución 0,43 M de HNO3, recientemente adoptada como estándar (ISO 2016) para estimar la fracción geoquímicamente reactiva del Cd. Esta fracción corresponde a la cantidad de Cd que se encuentra adsorbida y que puede movilizarse a la fase acuosa en cortos periodos mediante procesos de desorción y disolución (Groenenberg et al. 2017).
Por otro lado, las extracciones con soluciones salinas débiles, especialmente sales de Ca, han sido ampliamente utilizadas para estimar la fracción de metales pesados soluble en la fase acuosa del suelo, que se considera inmediatamente biodisponible para las plantas (Qin et al. 2024). Estas extracciones buscan simular las condiciones químicas e iónicas de la solución del suelo, lo que proporciona una mejor aproximación de la disponibilidad real del Cd. Una de las metodologías más utilizadas es la extracción con una solución 0,01 M CaCl2 (Huoba et al. 2000). Estas extracciones han sido utilizadas en estudios de modelamiento geoquímico como referencia para estimar la concentración de elementos solubles (Groenenberg et al. 2017, Gao et al. 2022).
En este contexto, un desafío actual para los laboratorios de análisis químicos de suelos del país es la validación de estas metodologías para complementar la información obtenida por medio de digestiones ácidas que se utilizan actualmente para cuantificar el contenido total de Cd en suelos. La implementación de estas técnicas permitiría generar información más detallada sobre la fracción reactiva y la biodisponibilidad del Cd, facilitando la aplicación de modelos geoquímicos avanzados para la especiación del metal en diferentes tipos de suelos. A su vez, esto permitiría mejorar la evaluación del riesgo ambiental y fortalecer el diseño de estrategias de mitigación para suelos agrícolas afectados por Cd.
Además de los factores geoquímicos, es fundamental evaluar el impacto de las prácticas de manejo agrícola sobre la disponibilidad de Cd, particularmente, en cultivos con alta capacidad de acumulación de este metal, como el cacao (Argüello et al. 2019). Dada la complejidad de las interacciones entre el Cd y los componentes del suelo, es probable que una misma práctica de manejo tenga efectos distintos en la biodisponibilidad del metal según las condiciones edáficas específicas.
A pesar de que no ha sido el enfoque principal de esta revisión, otra área emergente en la investigación sobre Cd en suelos es el estudio de la relación entre la comunidad microbiana del suelo y la bioacumulación de este elemento en agroecosistemas (Jaramillo-Mazo et al. 2024). Se han identificado diversos géneros bacterianos capaces de sobrevivir en suelos con altas concentraciones de Cd (Bravo et al. 2018, Bravo y Braissant 2022), algunos de los cuales podrían tener aplicaciones en estrategias de biorremediación para la descontaminación de suelos agrícolas (Bravo et al. 2018). Sin embargo, aún se conoce poco sobre los mecanismos específicos mediante los cuales estos microorganismos toleran y transforman el Cd, así como su papel en los procesos biogeoquímicos que determinan su movilidad y disponibilidad en el suelo. Actualmente, un proyecto de investigación liderado por el Laboratorio de Microbiología Agrícola (LMA) del Centro de Investigaciones Agronómicas (CIA), en colaboración con el Laboratorio de Suelos y Foliares (LSF-CIA) y el Instituto Nacional de Transferencia Agrícola (INTA), busca avanzar en esta línea de estudio, enfocándose en la comunidad bacteriana de la rizosfera del cacao y su efecto en la acumulación de Cd en estos agroecosistemas.
Finalmente, ampliar la investigación sobre Cd en suelos costarricenses abrirá oportunidades para extender el análisis a otros metales pesados, aprovechando los métodos de caracterización geoquímica desarrollados para dicho metal. Esto permitirá ampliar el conocimiento sobre la dinámica de contaminantes en suelos costarricenses y mejorar la evaluación de los riegos contaminación por metales pesados, lo cual es de gran relevancia para la gestión sostenible de suelos agrícolas y la protección de la calidad ambiental.
Conclusiones
El cadmio (Cd) es un elemento traza cuyo comportamiento químico en el ambiente ha sido ampliamente estudiado a nivel global. Al ser altamente tóxico para los organismos vivos, los estudios y regulaciones tanto fitosanitarias como ambientales son de suma importancia y de interés para la salud pública. En esta revisión, se han abordado los principales procesos geoquímicos que modulan la disponibilidad y movilidad del Cd en los suelos, los cuales son: adsorción, precipitación y formación de complejos solubles. Asimismo, se ha abordado las principales variables químicas de los suelos que modulan la intensidad e importancia de dichos procesos. Estas variables de mayor importancia son: el pH, potencial redox, contenido de materia orgánica y fuerza iónica (salinidad).
Entre las estrategias de manejo más recomendadas para disminuir la disponibilidad de Cd en los suelos destacan el encalado, la incorporación de enmiendas orgánicas y la fertilización adecuada con micronutrientes como el Zn. La comprensión de los procesos geoquímicos discutidos en esta revisión resulta fundamental para identificar las condiciones edáficas bajo las cuales estas prácticas pueden ser realmente eficaces en reducir la movilidad y biodisponibilidad del Cd.
En Costa Rica, los estudios del contenido de Cd tanto en suelos como en sedimentos se han circunscrito solamente al análisis del contenido total, lo cual ha permitido establecer información base que puede servir como un insumo inicial de información y para identificar zonas y actividades productivas con mayor riesgo de presentar problemas por contaminación con Cd. Sin embargo, el análisis de contenidos totales de este elemento no permite diferenciar distintas fracciones que están más directamente relacionadas con su disponibilidad.
Para estudios con fines ambientales y de toxicidad, es fundamental obtener información acerca de las fracciones más móviles o disponibles del Cd en los suelos. Lo anterior evidencia que existe un vacío de información con respecto a dicho tema, pero también una oportunidad que puede direccionar futuras investigaciones en el estudio de metales en los suelos del país. A pesar de que se han desarrollado algunos estudios en el país relacionado con el contenido de Cd en los suelos, persiste la interrogante de si su origen es predominantemente geogénico o antropogénico, y qué características químicas y mineralógicas tienen los suelos donde se han reportado los niveles de Cd total más elevados.
Literatura citada
Adams, ML; Zhao, FJ; McGrath, SP; Nicholson, FA; Chambers, BJ. 2004. Predicting cadmium concentrations in wheat and barley grain using soil properties. Journal of Environmental Quality 33(2):532-541. DOI: https://doi.org/10.2134/jeq2004.5320
Adhikari, T; Singh, MV. 2008. Remediation of cadmium pollution in soils by different amendments: A column study. Communications in Soil Science and Plant Analysis 39(3-4):386-396. DOI: https://doi.org/10.1080/00103620701826514
Adusei-Gyamfi, J; Ouddane, B; Rietveld, L; Cornard, J-P; Criquet, J. 2019. Natural organic matter-cations complexation and its impact on water treatment: A critical review. Water Research 160:130-147. DOI: https://doi.org/10.1016/j.watres.2019.05.064
Agegnehu, G; Srivastava, AK; Bird, MI. 2017. The role of biochar and biochar-compost in improving soil quality and crop performance: A review. Applied Soil Ecology 119:156-170. DOI: https://doi.org/10.1016/j.apsoil.2017.06.008
Ahmed, IAM; Young, SD; Mosselmans, JFW; Crout, NMJ; Bailey, EH. 2009. Coordination of Cd2+ ions in the internal pore system of zeolite-X: A combined EXAFS and isotopic exchange study. Geochimica et Cosmochimica Acta 73(6):1577-1587. DOI: https://doi.org/10.1016/j.gca.2008.12.018
Alloway, BJ; Steinnes, E. 1999. Anthropogenic additions of cadmium to soils. In McLaughlin, MJ; Singh, BR eds. Cadmium in soils and plants. Dordrecht, The Netherlands, Kluwer Academic Publishers. p. 97-123.
Alloway, BJ. 2013. Introduction. In Alloway, BJ (ed.). Heavy metals in soils. Dordrecht, Springer The Netherlands. p. 3-9 DOI: https://doi.org/10.1007/978-94-007-4470-7_1
Andersson, MP; Sakuma, H; Stipp, SLS. 2014. Strontium, nickel, cadmium, and lead substitution into calcite, studied by density functional theory. Langmuir 30(21):6129-6133. DOI: https://doi.org/10.1021/la500832u
Argüello, D; Chavez, E; Lauryssen, F; Vanderschueren, R; Smolders, E; Montalvo, D. 2019. Soil properties and agronomic factors affecting cadmium concentrations in cacao beans: A nationwide survey in Ecuador. Science of The Total Environment 649:120-127. DOI: https://doi.org/10.1016/j.scitotenv.2018.08.292
Arias, M; Barral, MT; Mejuto, JC. 2002. Enhancement of copper and cadmium adsorption on kaolin by the presence of humic acids. Chemosphere 48(10):1081-1088. DOI: https://doi.org/10.1016/S0045-6535(02)00169-8
Arthur, EL; Rice, PJ; Rice, PJ; Anderson, TA; Baladi, SM; Henderson, KLD; Coats, JR. 2005. Phytoremediation—An overview. Critical Reviews in Plant Sciences 24(2):109-122. DOI: https://doi.org/10.1080/07352680590952496
Ashraf, S; Ali, Q; Zahir, ZA; Ashraf, S; Asghar, HN. 2019. Phytoremediation: Environmentally sustainable way for reclamation of heavy metal polluted soils. Ecotoxicology and Environmental Safety 174:714-727. DOI: https://doi.org/10.1016/j.ecoenv.2019.02.068
Astolfi, S; Zuchi, S; Neumann, G; Cesco, S; di Toppi, LS; Pinton, R. 2012. Response of barley plants to Fe deficiency and Cd contamination as affected by S starvation. Journal of Experimental Botany 63(3):1241-1250. DOI: https://doi.org/10.1093/jxb/err344
Astruc, M. 1986. Evaluation of methods for the speciation of cadmium. In: Mislin, H; Ravera, O. (eds.). Cadmium in the environment. Birkhäuser, Basel. p. 12-17. DOI: https://doi.org/10.1007/978-3-0348-7238-6_2
Ballabio, C; Jones, A; Panagos, P. 2024. Cadmium in topsoils of the European Union – An analysis based on LUCAS topsoil database. Science of The Total Environment 912:168710. DOI: https://doi.org/10.1016/j.scitotenv.2023.168710
Benedetti, MF; Van Riemsdijk, WH; Koopal, LK; Kinniburgh, DG; Gooddy, DC; Milne, CJ. 1996. Metal ion binding by natural organic matter: From the model to the field. Geochimica et Cosmochimica Acta 60(14):2503-2513. DOI: https://doi.org/10.1016/0016-7037(96)00113-5
Birke, M; Reimann, C; Rauch, U; Ladenberger, A; Demetriades, A; Jähne-Klingberg, F; Oorts, K; Gosar, M; Dinelli, E; Halamić, J. 2017. GEMAS: Cadmium distribution and its sources in agricultural and grazing land soil of Europe — Original data versus clr-transformed data. Journal of Geochemical Exploration 173:13-30. DOI: https://doi.org/10.1016/j.gexplo.2016.11.007
Bolan, NS; Makino, T; Kunhikrishnan, A; Kim, PJ; Ishikawa, S; Murakami, M; Naidu, R; Kirkham, MB. 2013. chapter four - cadmium contamination and its risk management in rice ecosystems. Advances in Agronomy 119:183-273. DOI: https://doi.org/10.1016/B978-0-12-407247-3.00004-4
Boominathan, R; Doran, PM. 2003. Cadmium tolerance and antioxidative defenses in hairy roots of the cadmium hyperaccumulator, Thlaspi caerulescens. Biotechnology and Bioengineering 83(2):158-167. DOI: https://doi.org/10.1002/bit.10656
Boros-Lajszner, E; Wyszkowska, J; Kucharski, J. 2020. Application of white mustard and oats in the phytostabilisation of soil contaminated with cadmium with the addition of cellulose and urea. Journal of Soils and Sediments 20(2):931-942. DOI: https://doi.org/10.1007/s11368-019-02473-6
Bradl, HB. 2004. Adsorption of heavy metal ions on soils and soils constituents. Journal of Colloid and Interface Science 277(1):1-18. DOI: https://doi.org/10.1016/j.jcis.2004.04.005
Bravo, D; Braissant, O. 2022. Cadmium‐tolerant bacteria: Current trends and applications in agriculture. Letters in Applied Microbiology 74(3):311-333. DOI: https://doi.org/10.1111/lam.13594
Bravo, D; Pardo-Díaz, S; Benavides-Erazo, J; Rengifo-Estrada, G; Braissant, O; Leon-Moreno, C. 2018. Cadmium and cadmium-tolerant soil bacteria in cacao crops from northeastern Colombia. Journal of Applied Microbiology 124(5):1175-1194. DOI: https://doi.org/10.1111/jam.13698
Buekers, J; Degryse, F; Maes, A; Smolders, E. 2008. Modelling the effects of ageing on Cd, Zn, Ni and Cu solubility in soils using an assemblage model. European Journal of Soil Science 59(6):1160-1170. DOI: https://doi.org/10.1111/j.1365-2389.2008.01053.x
Burton, CH; Turner, C. 2003. Manure Management. Treatment strategies for sustainable agriculture. 2 ed. Bedford, UK, Silsoe Research Institute. 451 p.
Calvo-Brenes, G; Quirós-Bustos, N; Robles-Chaves, D; Caballero-Chavarría, A. 2024. Contenido de metales pesados en sedimentos de varios ríos de Costa Rica. Revista Tecnología en Marcha 37(4):141-151. DOI: https://doi.org/10.18845/tm.v37i4.6940
Campos, I; Abrantes, N; Keizer, JJ; Vale, C; Pereira, P. 2016. Major and trace elements in soils and ashes of eucalypt and pine forest plantations in Portugal following a wildfire. Science of The Total Environment 572:1363-1376. DOI: https://doi.org/10.1016/j.scitotenv.2016.01.190
Caporale, AG; Violante, A. 2016. Chemical processes affecting the mobility of heavy metals and metalloids in soil environments. Current Pollution Reports 2(1):15-27. DOI: https://doi.org/10.1007/s40726-015-0024-y
Carrillo, K; Martínez, M; Ramírez, L; Argüello, D; Chavez, E. 2023. Cadmium (Cd) distribution and soil-plant relationship in cacao farms in Costa Rica. Environmental Monitoring and Assessment 195(10):1209. DOI: https://doi.org/10.1007/s10661-023-11817-2
Carrillo-González, R; Šimůnek, J; Sauvé, S; Adriano, D. 2006. Mechanisms and pathways of trace element mobility in soils. Advances in Agronomy 91:111-178. DOI: https://doi.org/10.1016/S0065-2113(06)91003-7
Castillo-Muñoz, R. 2019. Atlas geoquímico de Costa Rica: suelos: fertilidad y medioambiente. San José, Costa Rica: Edinexo. 382 p.
Castillo-Muñoz, R. 2024. Atlas geoquímico de Costa Rica: sedimentos fluviales y rocas: medioambiente y Mineralización. 2 ed. San José, Costa Rica: Edinexo. 516 p.
Ciecko, Z; Wyszkowski, M; Krajewski, W; Zabielska, J. 2001. Effect of organic matter and liming on the reduction of cadmium uptake from soil by triticale and spring oilseed rape. Science of The Total Environment 281(1):37-45. DOI: https://doi.org/10.1016/S0048-9697(01)00800-2
Collins, CR; Ragnarsdottir, KV; Sherman, DM. 1999. Effect of inorganic and organic ligands on the mechanism of cadmium sorption to goethite. Geochimica et Cosmochimica Acta 63(19):2989-3002. DOI: https://doi.org/10.1016/S0016-7037(99)00226-4
Cornell, RM; Schwertmann, U. 2006. The iron oxides: Structure, properties, reactions, occurrences and uses. s.l. John Wiley & Sons. 707 p.
Davis, AP; Bhatnagar, V. 1995. Adsorption of cadmium and humic acid onto hematite. Chemosphere 30(2):243-256. DOI: https://doi.org/10.1016/0045-6535(94)00387-A
Diagboya, PN; Olu-Owolabi, BI; Adebowale, KO. 2015. Effects of time, soil organic matter, and iron oxides on the relative retention and redistribution of lead, cadmium, and copper on soils. Environmental Science and Pollution Research 22(13):10331-10339. DOI: https://doi.org/10.1007/s11356-015-4241-0
Dixon, JB; Schulze, DG; 2002. Soil mineralogy with environmental applications. SSSA Book Series. Madison, Wisconsin, USA, American Society of Agronomy. 866 p.
Du Laing, G; Rinklebe, J; Vandecasteele, B; Meers, E; Tack, FMG. 2009. Trace metal behaviour in estuarine and riverine floodplain soils and sediments: A review. Science of The Total Environment 407(13):3972-3985. DOI: https://doi.org/10.1016/j.scitotenv.2008.07.025
Du Laing, G; Vanthuyne, DRJ; Vandecasteele, B; Tack, FMG; Verloo, MG. 2007. Influence of hydrological regime on pore water metal concentrations in a contaminated sediment-derived soil. Environmental Pollution 147(3):615-625. DOI: https://doi.org/10.1016/j.envpol.2006.10.004
Elzinga, EJ; Kretzschmar, R. 2013. In situ ATR-FTIR spectroscopic analysis of the co-adsorption of orthophosphate and Cd(II) onto hematite. Geochimica et Cosmochimica Acta 117:53-64. DOI: https://doi.org/10.1016/j.gca.2013.04.003
Engbersen, N; Gramlich, A; Lopez, M; Schwarz, G; Hattendorf, B; Gutierrez, O; Schulin, R. 2019. Cadmium accumulation and allocation in different cacao cultivars. Science of The Total Environment 678:660-670. DOI: https://doi.org/10.1016/j.scitotenv.2019.05.001
European Food Safety Authority. 2012. Cadmium dietary exposure in the European population. EFSA Journal 10(1). DOI: https://doi.org/10.2903/j.efsa.2012.2551
Fan, K-C; Hsi, H-C; Chen, C-W; Lee, H-L; Hseu, Z-Y. 2011. Cadmium accumulation and tolerance of mahogany (Swietenia macrophylla) seedlings for phytoextraction applications. Journal of Environmental Management 92(10):2818-2822. DOI: https://doi.org/10.1016/j.jenvman.2011.06.032
Fletcher, P; Townsend, RP. 1982. Transition metal ion exchange in mixed ammoniumsodium X and Y zeolites. Journal of Chromatography A 238(1):59-68. DOI: https://doi.org/10.1016/S0021-9673(00)82711-9
Fuge, R; Pearce, FM; Pearce, NJG; Perkins, WT. 1993. Geochemistry of Cd in the secondary environment near abandoned metalliferous mines, Wales. Applied Geochemistry (Serie Environmental Geochemistry) 8:29-35. DOI: https://doi.org/10.1016/S0883-2927(09)80006-1
Fulda, B; Voegelin, A; Kretzschmar, R. 2013. Redox-controlled changes in cadmium solubility and solid-phase speciation in a paddy soil as affected by reducible sulfate and copper. Environmental Science & Technology 47(22):12775-12783. DOI: https://doi.org/10.1021/es401997d
Furcal-Beriguete, P; Torres-Morales, JL. 2020. Determinación de concentraciones de cadmio en plantaciones de Theobroma cacao L. en Costa Rica. Revista Tecnología en Marcha 33(1):122-137. DOI: https://doi.org/10.18845/tm.v33i1.5027
Gao, H; Koopmans, GF; Song, J; Groenenberg, JE; Liu, X; Comans, RNJ; Weng, L. 2022. Evaluation of heavy metal availability in soils near former zinc smelters by chemical extractions and geochemical modelling. Geoderma 423:115970. DOI: https://doi.org/10.1016/j.geoderma.2022.115970
Gardiner, J. 1974. The chemistry of cadmium in natural water—I a study of cadmium complex formation using the cadmium specific-ion electrode. Water Research 8(1):23-30. DOI: https://doi.org/10.1016/0043-1354(74)90005-0
Genchi, G; Sinicropi, MS; Lauria, G; Carocci, A; Catalano, A. 2020. The effects of cadmium toxicity. International Journal of Environmental Research and Public Health 17(11):3782. DOI: https://doi.org/10.3390/ijerph17113782
Gnandi, K.; Tobschall, H.J. 2002. Heavy metals distribution of soils around mining sites of cadmium-rich marine sedimentary phosphorites of Kpogame and Hahotoe (southern Togo). Environmental Geology 41:593-600. DOI: https://doi.org/10.1007/s002540100425
Gräfe, M; Singh, B; Balasubramanian, M. 2007. Surface speciation of Cd(II) and Pb(II) on kaolinite by XAFS spectroscopy. Journal of Colloid and Interface Science 315(1):21-32. DOI: https://doi.org/10.1016/j.jcis.2007.05.022
Gramlich, A; Tandy, S; Gauggel, C; López, M; Perla, D; Gonzalez, V; Schulin, R. 2018. Soil cadmium uptake by cocoa in Honduras. Science of The Total Environment 612:370-378. DOI: https://doi.org/10.1016/j.scitotenv.2017.08.145
Grant, CA. 2015. Influence of phosphate fertilizer on cadmium in agricultural soils and crops. In Selim, HM (ed.). Phosphate in Soils. CRC Press. 26 p.
Groenenberg, JE; Römkens, PFAM; Zomeren, AV; Rodrigues, SM; Comans, RNJ. 2017. Evaluation of the single dilute (0.43 M) nitric acid extraction to determine geochemically reactive elements in soil. Environmental Science & Technology 51(4):2246-2253. DOI: https://doi.org/10.1021/acs.est.6b05151
Guo, J; Wu, S; Zhang, X; Xie, H; Chen, F; Yang, Y; Zhu, R. 2023. The fate of Cd during the replacement of Cd-bearing calcite by calcium phosphate minerals. Environmental Pollution 316:120491. DOI: https://doi.org/10.1016/j.envpol.2022.120491
He, L-L; Huang, D-Y; Zhang, Q; Zhu, H-H; Xu, C; Li, B; Zhu, Q-H. 2021. Meta-analysis of the effects of liming on soil pH and cadmium accumulation in crops. Ecotoxicology and Environmental Safety 223:112621. DOI: https://doi.org/10.1016/j.ecoenv.2021.112621
He, S; He, Z; Yang, X; Stoffella, PJ; Baligar, VC. 2015. Chapter fur - Soil biogeochemistry, plant physiology, and phytoremediation of cadmium-contaminated soils. Advances in Agronomy 134:135-225 DOI: https://doi.org/10.1016/bs.agron.2015.06.005
Hiatt, V; Huff, JE. 1975. The environmental impact of cadmium: An overview. International Journal of Environmental Studies 7(4):277-285. DOI: https://doi.org/10.1080/00207237508709704
Hizal, J; Apak, R. 2006. Modeling of cadmium (II) adsorption on kaolinite-based clays in the absence and presence of humic acid. Applied Clay Science 32(3):232-244. DOI: https://doi.org/10.1016/j.clay.2006.02.002
Hoins, U; Charlet, L; Sticher, H. 1993. Ligand effect on the adsorption of heavy metals: The sulfate — Cadmium — Goethite case. Water, Air, and Soil Pollution 68(1):241-255. DOI: https://doi.org/10.1007/BF00479406
Houba, VJG; Temminghoff, EJM; Gaikhorst, GA; Vark. 2000. Soil analysis procedures using 0.01 M calcium chloride as extraction reagent. Communications in Soil Science and Plant Analysis 31: 1299-1396. DOI: https://doi.org/10.1080/00103620009370514
Huang, Q; Yu, Y; Wan, Y; Wang, Q; Luo, Z; Qiao, Y; Su, D; Li, H. 2018. Effects of continuous fertilization on bioavailability and fractionation of cadmium in soil and its uptake by rice (Oryza sativa L.). Journal of Environmental Management 215:13-21. DOI: https://doi.org/10.1016/j.jenvman.2018.03.036
Huang, S; Yamaji, N; Ma, JF. 2024. Metal transport systems in plants. Annual Review of Plant Biology 75:1-25. DOI: https://doi.org/10.1146/annurev-arplant-062923-021424
Huaraca-Fernandez, JN; Pérez-Sosa, L; Bustinza-Cabala, LS; Pampa-Quispe, NB. 2020. Enmiendas orgánicas en la inmovilización de cadmio en suelos agrícolas contaminados: una revisión. Información tecnológica 31(4):139-152. DOI: https://doi.org/10.4067/S0718-07642020000400139
Hutchinson, TC; Meema, KM. 1987. Lead, mercury, cadmium and arsenic in the environment. Chichester, Wiley. 384 p.
Ishchenko, V. 2019. Heavy metals in municipal waste: The content and leaching ability by waste fraction. Journal of Environmental Science and Health, Part A 54(14):1448-1456. DOI: https://doi.org/10.1080/10934529.2019.1655369
Ishikawa, S; Ishimaru, Y; Igura, M; Kuramata, M; Abe, T; Senoura, T; Hase, Y; Arao, T; Nishizawa, NK; Nakanishi, H. 2012. Ion-beam irradiation, gene identification, and marker-assisted breeding in the development of low-cadmium rice. Proceedings of the National Academy of Sciences 109(47):19166-19171. DOI: https://doi.org/10.1073/pnas.1211132109
ISO. 2016. ISO/DIS 17586 Soil quality - extraction of trace elements using dilute nitric acid. 14 p.
Jaramillo-Mazo, C; Bravo, D; Guerra Sierra, BE; Alvarez, JC. 2024. Association between bacterial community and cadmium distribution across Colombian cacao crops. Microbiology Spectrum 12(7):e03363-23. DOI: https://doi.org/10.1128/spectrum.03363-23
Jin, T; Nordberg, G; Ye, T; Bo, M; Wang, H; Zhu, G; Kong, Q; Bernard, A. 2004. Osteoporosis and renal dysfunction in a general population exposed to cadmium in China. Environmental Research 96(3):353-359. DOI: https://doi.org/10.1016/j.envres.2004.02.012
Julia, M; Putnis, CV; Filiberto, LH; Winkler, M. 2024. The capture of cadmium from solution during the replacement of calcite by apatite. ACS Earth and Space Chemistry 8(7):1339-1348. DOI: https://doi.org/10.1021/acsearthspacechem.4c00031
Karlsson, T; Elgh-Dalgren, K; Björn, E; Skyllberg, U. 2007. Complexation of cadmium to sulfur and oxygen functional groups in an organic soil. Geochimica et Cosmochimica Acta 71(3):604-614. DOI: https://doi.org/10.1016/j.gca.2006.10.011
Khan, MA; Khan, S; Khan, A; Alam, M. 2017. Soil contamination with cadmium, consequences and remediation using organic amendments. Science of The Total Environment 601-602:1591-1605. DOI: https://doi.org/10.1016/j.scitotenv.2017.06.030
Kirkham, MB. 2006. Cadmium in plants on polluted soils: Effects of soil factors, hyperaccumulation, and amendments. Geoderma 137(1):19-32. DOI: https://doi.org/10.1016/j.geoderma.2006.08.024
Köleli, N; Eker, S; Cakmak, I. 2004. Effect of zinc fertilization on cadmium toxicity in durum and bread wheat grown in zinc-deficient soil. Environmental Pollution 131(3):453-459. DOI: https://doi.org/10.1016/j.envpol.2004.02.012
Kong, L-X; Guo, Z; Peng, C; Xiao, X; He, Y. 2021. Factors influencing the effectiveness of liming on cadmium reduction in rice: A meta-analysis and decision tree analysis. Science of the Total Environment 779: 146477. DOI: https://doi.org/10.1016/j.scitotenv.2021.146477
Kozera-Sucharda, B; Gworek, B; Kondzielski, I. 2020. The simultaneous removal of zinc and cadmium from multicomponent aqueous solutions by their sorption onto selected natural and synthetic zeolites. Minerals 10(4):343. DOI: https://doi.org/10.3390/min10040343
Kozyatnyk, I; Bouchet, S; Björn, E; Haglund, P. 2016. Fractionation and size-distribution of metal and metalloid contaminants in a polluted groundwater rich in dissolved organic matter. Journal of Hazardous Materials 318:194-202. DOI: https://doi.org/10.1016/j.jhazmat.2016.07.024
Kubier, A; Pichler, T. 2019. Cadmium in groundwater − A synopsis based on a large hydrogeochemical data set. Science of The Total Environment 689:831-842. DOI: https://doi.org/10.1016/j.scitotenv.2019.06.499
Kubier, A; Wilkin, RT; Pichler, T. 2019. Cadmium in soils and groundwater: A review. Applied Geochemistry 108:104388. DOI: https://doi.org/10.1016/j.apgeochem.2019.104388
Lai, C-H; Chen, C-Y; Wei, B-L; Yeh, S-H. 2002. Cadmium adsorption on goethite-coated sand in the presence of humic acid. Water research 36(20):4943-4950. DOI: https://doi.org/10.1016/s0043-1354(02)00009-x
Lamy, I; Djafer, M; Terce, M. 1991. Influence of oxalic acid on the adsorption of cadmium at the goethite surface. Water, Air, and Soil Pollution 57(1):457-465. DOI: https://doi.org/10.1007/BF00282909
Lee, HH; Owens, VN; Park, S; Kim, J; Hong, CO. 2018. Adsorption and precipitation of cadmium affected by chemical form and addition rate of phosphate in soils having different levels of cadmium. Chemosphere 206:369-375. DOI: https://doi.org/10.1016/j.chemosphere.2018.04.176
Li, MS. 2006. Ecological restoration of mineland with particular reference to the metalliferous mine wasteland in China: A review of research and practice. Science of The Total Environment 357(1):38-53. DOI: https://doi.org/10.1016/j.scitotenv.2005.05.003
Li, X; Schindler, M; Zhou, J; Samaradiwakara, S; Wu, L. 2024. Interaction between metal(loid)s and soil mineral-organic matter associations. Critical Reviews in Environmental Science and Technology, 1–24. DOI: https://doi.org/10.1080/10643389.2024.2434328
Li, YM; Chaney, RL; Schneiter, AA. 1994. Effect of soil chloride level on cadmium concentration in sunflower kernels. Plant Soil 167:275-280. DOI: https://doi.org/10.1007/BF00007954
Liao, P; Huang, S; Zeng, Y; Shao, H; Zhang, J; van Groenigen, KJ. 2021. Liming increases yield and reduces grain cadmium concentration in rice paddies: a meta-analysis. Plant and Soil 465(1):157-169. DOI: https://doi.org/10.1007/s11104-021-05004-w
Lin, L; Ning, B; Liao, M; Ren, Y; Wang, Z; Liu, Y; Cheng, J; Luo, L. 2014. Youngia erythrocarpa, a newly discovered cadmium hyperaccumulator plant. Environmental Monitoring and Assessment 187(1):4205. DOI: https://doi.org/10.1007/s10661-014-4205-8
Liu, A; Gonzalez, RD. 2000. Modeling adsorption of copper(II), cadmium(II) and lead(II) on purified humic acid. Langmuir 16(8):3902-3909. DOI: https://doi.org/10.1021/la990607x
Liu, H; Lu, X; Cui, X; Zhang, L; Chan, T-S. 2022a. Atomistic mechanism of cadmium incorporation into hydroxyapatite. American Mineralogist 107(4):664-672. DOI: https://doi.org/10.2138/am-2020-7560
Liu, L; Li, Y; Tang, J; Hu, L; Chen, X. 2011. Plant coexistence can enhance phytoextraction of cadmium by tobacco (Nicotiana tabacum L.) in contaminated soil. Journal of Environmental Sciences 23(3):453-460. DOI: https://doi.org/10.1016/S1001-0742(10)60430-5
Liu, Q; Huang, L; Chen, Z; Wen, Z; Ma, L; Xu, S; Wu, Y; Liu, Y; Feng, Y. 2022b. Biochar and its combination with inorganic or organic amendment on growth, uptake and accumulation of cadmium on lettuce. Journal of Cleaner Production 370:133610. DOI: https://doi.org/10.1016/j.jclepro.2022.133610
Liu, Y; Xiao, T; Perkins, RB; Zhu, J; Zhu, Z; Xiong, Y; Ning, Z. 2017. Geogenic cadmium pollution and potential health risks, with emphasis on black shale. Journal of Geochemical Exploration176:42-49. DOI: https://doi.org/10.1016/j.gexplo.2016.04.004
Liu, Z; Huang, Y; Ji, X; Xie, Y; Peng, J; Eissa, MA; Fahmy, AE; Abou-Elwafa, SF. 2020. Effects and mechanism of continuous liming on cadmium immobilization and uptake by rice grown on acid paddy soils. Journal of Soil Science and Plant Nutrition 20(4):2316-2328. DOI: https://doi.org/10.1007/s42729-020-00297-9
Loganathan, P; Vigneswaran, S; KANDASAMY, J; Naidu, R. 2012. Cadmium sorption and desorption in soils: A Review. Critical Reviews in Environmental Science and Technology 42:489-533. DOI: https://doi.org/10.1080/10643389.2010.520234
López-Alonso, M; Benedito, JL; Miranda, M; Castillo, C; Hernández, J; Shore, RF. 2000. Arsenic, cadmium, lead, copper and zinc in cattle from Galicia, NW Spain. Science of The Total Environment 246(2-3):237-248. DOI: https://doi.org/10.1016/S0048-9697(99)00461-1
Lutzenkirchen, J. 1997. Ionic strength effects on cation sorption to oxides: Macroscopic observations and their significance in microscopic interpretation. Journal of Colloid and Interface Science 195(1):149-155. DOI: https://doi.org/10.1006/jcis.1997.5160
MacDonald, DD; Ingersoll, CG; Berger, TA. 2000. Development and evaluation of consensus-based sediment quality guidelines for freshwater ecosystems. Archives of environmental contamination and toxicology 39(1):20-31. DOI: https://doi.org/10.1007/s002440010075
Mar, SS; Okazaki, M. 2012. Investigation of Cd contents in several phosphate rocks used for the production of fertilizer. Microchemical Journal 104:17-21. DOI: https://doi.org/10.1016/j.microc.2012.03.020
McGowen, S l.; Basta, N t.; Brown, G o. 2001. Use of diammonium phosphate to reduce heavy metal solubility and transport in smelter-contaminated soil. Journal of Environmental Quality 30(2):493-500. DOI: https://doi.org/10.2134/jeq2001.302493x
McKenna, IM; Chaney, RL; Williams, FM. 1993. The effects of cadmium and zinc interactions on the accumulation and tissue distribution of zinc and cadmium in lettuce and spinach. Environmental Pollution 79(2):113-120. DOI: https://doi.org/10.1016/0269-7491(93)90060-2
McLaughlin, MJ; Tiller, KG; Smart, MK. 1997. Speciation of cadmium in soil solutions of saline/sodic soils and relationship with cadmium concentrations in potato tubers (Solanum tuberosum L.). Soil Research 35:183-198. DOI: https://doi.org/10.1071/S96032
McLean, JE; Bledsoe, BE. 1992. Behavior of metals in soils. Utah State Univ., Logan, UT (United States). Utah Water Research Lab. Consultado 23 feb. 2025. Disponible en https://www.osti.gov/biblio/6754469
Mench, M; Lepp, N; Bert, V; Schwitzguébel, J-P; Gawronski, SW; Schröder, P; Vangronsveld, J. 2010. Successes and limitations of phytotechnologies at field scale: Outcomes, assessment and outlook from COST Action 859. Journal of Soils and Sediments 10(6):1039-1070. DOI: https://doi.org/10.1007/s11368-010-0190-x
MAG (Ministerio de Agricultura y Ganadería). 2016. Reglamento Técnico de Centro América. RTCR 485:2016. Sustancias químicas. Fertilizantes y enmiendas para uso agrícola. Tolerancias y límites permitidos para la concentración de los elementos y contaminantes. San José, Costa Rica. s .p.
Ministerio de Salud, Decreto ejecutivo N.° 37757-S. 2014. Reglamento sobre valores guía en suelos para descontaminación de sitios afectados por emergencias ambientales y derrames. Diario oficial La Gaceta, San José, Costa Rica, 11 julio. Disponible en http://www.pgrweb.go.cr/scij/Busqueda/Normativa/Normas/nrm_texto_completo.aspx?param1=NRTC&nValor1=1&nValor2=75223&nValor3=93682&strTipM=TC
Molina-Roco, M; Gómez, V; Kalazich, J; Hernández, J. 2024. Cadmium (Cd) accumulation in potato (Solanum tuberosum L.) cropping systems: A Review. Journal of Soil Science and Plant Nutrition 24:1574-1591. DOI: https://doi.org/10.1007/s42729-024-01658-4
Mora, R; Mora, R. 2005. Contaminación por metales pesados en sedimentos de Quebrada Azul. Revista de Ciencias Ambientales (Trop J Envirn Sci) 29(1): 63-75. DOI: http://dx.doi.org/10.15359/rca.29-1.6
Muehe, EM; Adaktylou, IJ; Obst, M; Zeitvogel, F; Behrens, S; Planer-Friedrich, B; Kraemer, U; Kappler, A. 2013. Organic carbon and reducing conditions lead to cadmium immobilization by secondary Fe mineral formation in a pH-Neutral soil. Environmental Science & Technology 47(23):13430-13439. DOI: https://doi.org/10.1021/es403438n
Naidu, R; Bolan, NS; Kookana, RS; Tiller, KG. 1994. Ionic-strength and pH effects on the sorption of cadmium and the surface charge of soils. European Journal of Soil Science 45(4):419-429. DOI: https://doi.org/10.1111/j.1365-2389.1994.tb00527.x
Nelson, SS; Yonge, DR; Barber, ME. 2009. Effects of road salts on heavy metal mobility in two eastern Washington soils. Journal of Environmental Engineering 135(7):505-510. DOI: https://doi.org/10.1061/(ASCE)0733-9372(2009)135:7(505)
Neue, HU; Mamaril, CP. 1985. Zinc, sulphur and other micronutrients in wetland soils. Wetland soils: Characterization, classification and utilization. Manila, Philippines: International Rice Research Institute. p. 307-20.
Ni, TH; Wei, YZ. 2003. Subcellular distribution of cadmium in mining ecotype Sedum alfredii. Acta Botanica Sinica 45(8):925-928.
NIAST (National Institute of Agricultural Science and Technology, Korea). 1997. Survey of heavy metals contamination degree of arable soil located in mining area Annu. Rep. (Department Agric. Environment). p. 237-243.
Nordberg, GF; Fowler, BA; Nordberg, M. 2015. Handbook on the toxicology of metals. 4 ed. Amsterdam, Academic Press. 1542 p. DOI: https://doi.org/10.1016/C2011-0-07884-5
O’Connor, GA; O’Connor, C; Cline, GR. 1984. Sorption of cadmium by calcareous soils: Influence of solution composition. Soil Science Society of America Journal 48(6):1244-1247. DOI: https://doi.org/10.2136/sssaj1984.03615995004800060008x
Obando, BV. 2021. Metales traza (As, Cr, Cd, Co, Ni, Pb) en plantaciones bananeras de Costa Rica y efecto del cromo en el crecimiento y la absorción de nutrimentos en la planta de banano (Musa AAA). Tesis de Maestría en Química. San Pedro, Costa Rica, Universidad de Costa Rica. s. p.
Ören, AH; Kaya, A. 2006. Factors affecting adsorption characteristics of Zn2+ on two natural zeolites. Journal of Hazardous Materials 131(1):59-65. DOI: https://doi.org/10.1016/j.jhazmat.2005.09.027
Peng, Z; Lin, X; Zhang, Y; Hu, Z; Yang, X; Chen, C; Chen, H; Li, Y; Wang, J. 2021. Removal of cadmium from wastewater by magnetic zeolite synthesized from natural, low-grade molybdenum. Science of The Total Environment 772:145355. DOI: https://doi.org/10.1016/j.scitotenv.2021.145355
Peters, RW; Shem, L. 1992. Adsorption/desorption characteristics of lead on various types of soil. Environmental Progress 11(3):234-240. DOI: https://doi.org/10.1002/ep.670110322
Qafoku, N; VanRanst, E; Noble, A; Baert, G. 2004. Variable charge soils: Mineralogy, chemistry and management. Advances in Agronomy 84:159-215. DOI: https://doi.org/10.1016/S0065-2113(04)84004-5
Qin, Y; Groenenberg, JE; Viala Y; Alves S; Comans RNJ. 2024. Optimizing multi-surface modelling of available cadmium as measured in soil pore water and salt extracts of soils amended with compost and lime: The role of organic matter and reactive metal. Science of the Total Environment 957:177769. DOI: https://doi.org/10.1016/j.scitotenv.2024.177769
Quezada-Hinojosa, RP; Matera, V; Adatte, T; Rambeau, C; Föllmi, KB. 2009. Cadmium distribution in soils covering Jurassic oolitic limestone with high Cd contents in the Swiss Jura. Geoderma 150(3):287-301. DOI: https://doi.org/10.1016/j.geoderma.2009.02.013
Ramstedt, M; Norgren, C; Shchukarev, A; Sjöberg, S; Persson, P. 2005. Co-adsorption of cadmium(II) and glyphosate at the water–manganite (γ-MnOOH) interface. Journal of Colloid and Interface Science 285(2):493-501. DOI: https://doi.org/10.1016/j.jcis.2004.12.003
Randall, SR; Sherman, DM; Ragnarsdottir, KV; Collins, CR. 1999. The mechanism of cadmium surface complexation on iron oxyhydroxide minerals. Geochimica et Cosmochimica Acta 63(19):2971-2987. DOI: https://doi.org/10.1016/S0016-7037(99)00263-X
Rasa, K; Peltovuori, T; Hartikainen, H. 2006. Effects of de-icing chemicals sodium chloride and potassium formate on cadmium solubility in a coarse mineral soil. Science of The Total Environment 366(2):819-825. DOI: https://doi.org/10.1016/j.scitotenv.2005.08.007
Rodríguez, P. 2014. Contenidos de los metales pesados: cadmio, arsénico, mercurio y plomo en las materias primas usadas para la elaboración de premezclas minerales y en el hígado de bovinos. Tesis Lic. en Zootecnia. San José, Costa Rica, Universidad de Costa Rica. 119 p.
Ruyter-Hooley, M; Larsson, A-C; Johnson, BB; Antzutkin, ON; Angove, MJ. 2016. The effect of inositol hexaphosphate on cadmium sorption to gibbsite. Journal of Colloid and Interface Science 474:159-170. DOI: https://doi.org/10.1016/j.jcis.2016.04.028
Sanchez, P. 2019. Properties and management of soils in the Tropics. 2 ed. Cambridge, United Kingdom, Cambridge University Press. 666 p.
Santasnachok, C; Kurniawan, W; Hinode, H. 2015. The use of synthesized zeolites from power plant rice husk ash obtained from Thailand as adsorbent for cadmium contamination removal from zinc mining. Journal of Environmental Chemical Engineering 3(3):2115-2126. DOI: https://doi.org/10.1016/j.jece.2015.07.016
Sarwar, N; Ullah, S; Malhi, S; Zia, M; Naeem, A; Saif, S; Farid, G. 2010. Role of mineral nutrition in minimizing cadmium accumulation by plants. Journal of Science of food and agriculture 90. DOI: https://doi.org/10.1002/jsfa.3916
Sasaki, A; Yamaji, N; Yokosho, K; Ma, JF. 2012. Nramp5 is a major transporter responsible for manganese and cadmium uptake in rice. The Plant Cell 24(5):2155-2167. DOI: https://doi.org/10.1105/tpc.112.096925
Sauvé, S; Norvell, WA; McBride, M; Hendershot, W. 2000. Speciation and complexation of cadmium in extracted soil solutions. Environmental Science & Technology 34(2):291-296. DOI: https://doi.org/10.1021/es990202z
Schweizer, SA; Bachelder, J; Hoeschen, C; Weng, ZH; Kopittke, PM; Frossard, E; Wiggenhauser, M. 2024. Preferential Zn and Cd hotspots in soil microarchitecture. Environmental Science & Technology Letters. DOI: https://doi.org/10.1021/acs.estlett.4c00401
Shi, J; Du, P; Luo, H; Wu, H; Zhang, Y; Chen, J; Wu, M; Xu, G; Gao, H. 2022. Soil contamination with cadmium and potential risk around various mines in China during 2000–2020. Journal of Environmental Management 310:114509. DOI: https://doi.org/10.1016/j.jenvman.2022.114509
Shi, Z; Zhang, Z; Yuan, M; Wang, S; Yang, M; Yao, Q; Ba, W; Zhao, J; Xie, B. 2020. Characterization of a high cadmium accumulating soil bacterium, Cupriavidus s. p. WS2. Chemosphere 247:125834. DOI: https://doi.org/10.1016/j.chemosphere.2020.125834
Shirvani, M; Shariatmadari, H; Kalbasi, M; Nourbakhsh, F; Najafi, B. 2006. Sorption of cadmium on palygorskite, sepiolite and calcite: Equilibria and organic ligand affected kinetics. Colloids and Surfaces A: Physicochemical and Engineering Aspects 287(1):182-190. DOI: https://doi.org/10.1016/j.colsurfa.2006.03.052
Silva, JRR; Fernandes, AR; Silva Junior, ML; Santos, CRC; Lobato, AKS. 2018. Tolerance mechanisms in Cassia alata exposed to cadmium toxicity – potential use for phytoremediation. Photosynthetica 56(2):495-504. DOI: https://doi.org/10.1007/s11099-017-0698-z
Smolders, E; Lambregts, RM; McLaughlin, MJ; Tiller, KG. 1998. Effect of soil solution chloride on cadmium availability to Swiss chard. Journal of Environmental Quality 27(2):426-431. DOI: https://doi.org/10.2134/jeq1998.00472425002700020025x
Smolders, E; Mertens, J. 2013. Cadmium. In Alloway, BJ (ed.). Heavy metals in soils. Dordrecht, Springer Netherlands. p. 283-311 DOI: https://doi.org/10.1007/978-94-007-4470-7_10
Sohi, S; Krull, E; Lopez-Capel, E; Bol, R. 2010. Chapter 2 - A review of biochar and its use and function in soil. Advances in Agronomy 105:47-82. DOI: https://doi.org/10.1016/S0065-2113(10)05002-9
Sposito, G. 1987. Distinguishing adsorption from surface precipitation. In Davis, JA; Hayes, KF (eds.). Geochemical processes at mineral surfaces. Washington DC, American Chemical Society. p. 217-228. DOI: https://doi.org/10.1021/bk-1987-0323.ch011
Strawn, DG; Bohn, HL; O’Connor GA. 2015. Soil chemistry, 4 ed. Newark, Wiley-Blackwell. 394 p.
Subašić, M; Šamec, D; Selović, A; Karalija, E. 2022. Phytoremediation of cadmium polluted soils: Current status and approaches for enhancing. Soil Systems 6(1):3. DOI: https://doi.org/10.3390/soilsystems6010003
Sun, R; Zhou, Q; Jin, C. 2006. Cadmium accumulation in relation to organic acids in leaves of Solanum nigrum L. as a newly found cadmium hyperaccumulator. Plant and Soil 285(1):125-134. DOI: https://doi.org/10.1007/s11104-006-0064-6
Swedlund, PJ; Webster, JG; Miskelly, GM. 2003. The effect of SO4 on the ferrihydrite adsorption of Co, Pb and Cd: Ternary complexes and site heterogeneity. Applied Geochemistry 18(11):1671-1689. DOI: https://doi.org/10.1016/S0883-2927(03)00082-9
Tessier, A; Fortin, D; Belzile, N; DeVitre, RR; Leppard, GG. 1996. Metal sorption to diagenetic iron and manganese oxyhydroxides and associated organic matter: Narrowing the gap between field and laboratory measurements. Geochimica et Cosmochimica Acta 60(3):387-404. DOI: https://doi.org/10.1016/0016-7037(95)00413-0
Thomine, S; Wang, R; Ward, J; Crawford, N; Schroeder, J. 2000. Cadmium and iron transport by members of a plant metal transporter family in Arabidopsis with homology to Nramp genes. Proceedings of the National Academy of Sciences of the United States of America 97:4991-6. DOI: https://doi.org/10.1073/pnas.97.9.4991
Tiberg, C; Gustafsson, J. 2016. Phosphate effects on cadmium(II) sorption to ferrihydrite. Journal of Colloid and Interface Science 471. DOI: https://doi.org/10.1016/j.jcis.2016.03.016
Tlustoš, P; Száková, J; Kořínek, K; Pavlíková, D; Hanč, A; Balík, J. 2006. The effect of liming on cadmium, lead, and zinc uptake reduction by spring wheat grown in contaminated soil. Plant, Soil and Environment 52(1):16-24. DOI: https://doi.org/10.17221/3341-PSE
UNEP (United Nations Environment Programme). 2010. Final review of scientific information on cadmium. Geneva, Switzerland, UNEP. 201 p.
van der Ent, A; Baker, AJM; Reeves, RD; Pollard, AJ; Schat, H. 2013. Hyperaccumulators of metal and metalloid trace elements: Facts and fiction. Plant and Soil 362(1):319-334. DOI: https://doi.org/10.1007/s11104-012-1287-3
Vanderschueren, R; Argüello, D; Blommaert, H; Montalvo, D; Barraza, F; Maurice, L; Schreck, E; Schulin, R; Lewis, C; Vazquez, JL; Umaharan, P; Chavez, E; Sarret, G; Smolders, E. 2021. Mitigating the level of cadmium in cacao products: Reviewing the transfer of cadmium from soil to chocolate bar. Science of The Total Environment 781:146779. DOI: https://doi.org/10.1016/j.scitotenv.2021.146779
Verbeeck, M; Salaets, P; Smolders, E. 2020. Trace element concentrations in mineral phosphate fertilizers used in Europe: A balanced survey. Science of The Total Environment 712:136419. DOI: https://doi.org/10.1016/j.scitotenv.2019.136419
Vert, G; Grotz, N; Dédaldéchamp, F; Gaymard, F; Guerinot, ML; Briat, J-F; Curie, C. 2002. IRT1, an Arabidopsis transporter essential for iron uptake from the soil and for plant growth. The Plant Cell 14(6):1223-1233. DOI: https://doi.org/10.1105/tpc.001388
Wang, J; Wang, P-M; Gu, Y; Kopittke, PM; Zhao, F-J; Wang, P. 2019. Iron–manganese (Oxyhydro)oxides, rather than oxidation of sulfides, determine mobilization of Cd during soil drainage in paddy soil systems. Environmental Science & Technology 53(5):2500-2508. DOI: https://doi.org/10.1021/acs.est.8b06863
Welikala, D; Robinson, BH; Moltchanova, E; Hartland, A; Lehto, NJ. 2021. Soil cadmium mobilisation by dissolved organic matter from soil amendments. Chemosphere 271:129536. DOI: https://doi.org/10.1016/j.chemosphere.2021.129536
Weng, L; Temminghoff, EJM; Van Riemsdijk, WH. 2001. Contribution of individual sorbents to the control of heavy metal activity in sandy soil. Environmental Science & Technology 35(22):4436-4443. DOI: https://doi.org/10.1021/es010085j
World Health Organization (WHO). 2022. Evaluation of certain food additives and contaminants: ninety-first report of the Joint FAO/WHO Expert Committee on Food Additives (en línea). s.l. World Health Organization. Consultado 23 feb. 2025. Disponible en https://iris.who.int/handle/10665/364702
Wu, J; Song, Q; Zhou, J; Wu, Y; Liu, X; Liu, J; Zhou, L; Wu, Z; Wu, W. 2021. Cadmium threshold for acidic and multi-metal contaminated soil according to Oryza sativa L. Cadmium accumulation: Influential factors and prediction model. Ecotoxicology and Environmental Safety 208:111420. DOI: https://doi.org/10.1016/j.ecoenv.2020.111420
Wuana, RA; Okieimen, FE. 2011. Heavy metals in contaminated soils: A review of sources, chemistry, risks and best available strategies for remediation. International Scholarly Research Notices 2011(1):402647. DOI: https://doi.org/10.5402/2011/402647
Yang, Y; Chen, J; Huang, Q; Tang, S; Wang, J; Hu, P; Shao, G. 2018. Can liming reduce cadmium (Cd) accumulation in rice (Oryza sativa) in slightly acidic soils? A contradictory dynamic equilibrium between Cd uptake capacity of roots and Cd immobilisation in soils. Chemosphere 193:547-556. DOI: https://doi.org/10.1016/j.chemosphere.2017.11.061
Yu, G; Liu, J; Long, Y; Chen, Z; Sunahara, GI; Jiang, P; You, S; Lin, H; Xiao, H. 2020. Phytoextraction of cadmium-contaminated soils: Comparison of plant species and low molecular weight organic acids. International Journal of Phytoremediation 22(4):383-391. DOI: https://doi.org/10.1080/15226514.2019.1663488
Yu, HY; Chuanping, L; Zhu, J; Li, F; Deng, DM; Wang, Q; Liu, C. 2020. Cadmium availability in rice paddy fields from a mining area: The effects of soil properties highlighting iron fractions and pH value. Environmental Pollution 209:38-45. DOI: http://dx.doi.org/10.1016/j.envpol.2015.11.021
Zaniewicz-Bajkowska, A; Rosa, R; Franczuk, J; Kosterna, E. 2007. Direct and secondary effect of liming and organic fertilization on cadmium content in soil and in vegetables. Plant, Soil and Environment 53(11):473-481. DOI: https://doi.org/10.17221/2305-PSE
Zgorelec, Ž; Bilandzija, N; Knez, K; Galić, M; Žužul, S. 2020. Cadmium and Mercury phytostabilization from soil using Miscanthus × giganteus. Scientific Reports 10: 6685. DOI: https://doi.org/10.1038/s41598-020-63488-5
Zhao, W; Xu, Y; Gu, L; Zhu, M; Yang, P; Gu, C; Liu, Z; Feng, X; Tan, W; Huang, Q; Wang, X. 2024. Elucidating phosphate and cadmium cosorption mechanisms on mineral surfaces with direct spectroscopic and modeling evidence. Environmental Science & Technology 58(45):20211-20223. DOI: https://doi.org/10.1021/acs.est.4c08847
Zhu, H; Chen, C; Xu, C; Zhu, Q; Huang, D. 2016. Effects of soil acidification and liming on the phytoavailability of cadmium in paddy soils of central subtropical China. Environmental Pollution 219:99-106. DOI: https://doi.org/10.1016/j.envpol.2016.10.043
Zulfiqar, U; Jiang, W; Xiukang, W; Hussain, S; Ahmad, M; Maqsood, MF; Ali, N; Ishfaq, M; Kaleem, M; Haider, FU; Farooq, N; Naveed, M; Kucerik, J; Brtnicky, M; Mustafa, A. 2022. Cadmium phytotoxicity, tolerance, and advanced remediation approaches in agricultural soils: A comprehensive review. Front. Plant Sci 13: 773815. DOI: https://doi.org/10.3389/fpls.2022.773815
![]()