Agronomía Costarricense 49 (2025) 3580

Nota técnica
Yanina Ibáñez-Marín1/*, Néstor Urretabizkaya-Servidio2, Laura Juan-Iotti3, Federico Sassano-Jorge4, Marta M. Astiz-Gassó5
*Autora para correspondencia. Correo electrónico: yibanez@agrarias.unlz.edu.ar
1Universidad Nacional de Lomas de Zamora, Facultad de Ciencias
Agrarias, IIPAS, Instituto de Investigación de Producción Ambiente y Salud,
Argentina. ![]() https://orcid.org/0009-0008-2014-6556
https://orcid.org/0009-0008-2014-6556
2Universidad Nacional de Lomas de Zamora, Facultad de Ciencias
Agrarias, IIPAS, Instituto de Investigación de Producción Ambiente y Salud,
Argentina. ![]() https://orcid.org/0000-0002-6101-4997
https://orcid.org/0000-0002-6101-4997
3Universidad Nacional de Lomas de Zamora, Facultad de Ciencias
Agrarias, IIPAS, Instituto de Investigación de Producción Ambiente y Salud,
Argentina. ![]() https://orcid.org/0009-0006-6947-8717
https://orcid.org/0009-0006-6947-8717
4Universidad Nacional de Lomas de Zamora Facultad de Ciencias
Agrarias, Argentina. ![]() https://orcid.org/0009-0007-5737-2533
https://orcid.org/0009-0007-5737-2533
5Universidad Nacional de La Plata, Facultad de Ciencias Agrarias y
Forestales, Instituto Fitotécnico Santa Catalina, Argentina. ![]() https://orcid.org/0009-0005-9572-9703
https://orcid.org/0009-0005-9572-9703
DOI: https://doi.org/10.15517/az75bq80
Recibido el 26 de marzo del 2025; Aceptado el 27 de junio del 2025
Resumen
Introducción. Agroathelia rolfsii (Sacc.) Redhead & Mullineaux es un patógeno edáfico polífago capaz de afectar a diversidad de especies, incluyendo el cultivo de soja. Su incidencia puede ocasionar disminución del número de plantas y reducciones en la producción, que oscilan entre 10-25% en años normales y superar el 50% en brotes severos, según las zonas afectadas. Objetivo. Determinar la dosis mínima de esclerocios capaz de inducir síntomas en las plantas de soja. Materiales y métodos. Se realizaron bioensayos en cámara de crecimiento. Se aplicaron tres dosis diferentes de esclerocios: 0,163 g, 0,326 g y 0,489 g, por unidad experimental. Resultados y discusión. Se encontraron diferencias significativas en la severidad de la enfermedad entre los tratamientos. Los tratamientos con 0,326 g y 0,489 g de esclerocios expresaron el 70 y 82% de síntomas, respectivamente. La necrosis en la base del tallo y la presencia de cancros fueron los síntomas predominantes. Las dosis del patógeno utilizadas establecieron una relación lineal entre la aparición de síntomas y la dosis de esclerocios, descrita por la ecuación: % PCS = 7,00 + 170,16 * D (g).
Se observó una correlación significativa negativa de -0,40 (p = 0,0144) entre el peso fresco de los tallos y la dosis del patógeno. Conclusión. Los resultados obtenidos indican que la dosis mínima de inóculo de 0,163 g de esclerocios puede inducir la expresión de la enfermedad en el cultivo de soja.
Palabras clave: Glycine max; Sclerotium rolfsii; severidad; hongos de suelo; bioensayo.
Technical note
Abstract
Inoculation method with sclerotia of Agroathelia rolfsii (Sacc.) Redhead & Mullineaux in soybean (Glycine max L. Merr.) crops
Introduction. Agroathelia rolfsii (Sacc.) Redhead & Mullineaux is a polyphagous soil pathogen capable of affecting a variety of species, including the soybean crop. Its incidence can cause a decrease in the number of plants and yield losses ranging from 10-25% in normal years to over 50% in severe outbreaks, depending on the areas affected. Objective. To determine the minimum dose of sclerotia that causes symptoms in soybean plants. Materials and methods. Bioassays were carried out in a growth chamber. Three different doses of sclerotia 0.163 g, 0.326 g and 0.489 g per experimental unit were applied. Results and discussion. Significant differences in disease severity were found among treatments. Treatments with 0.326 g and 0.489 g of sclerotia expressed 70 and 82% symptoms, respectively. Necrosis at the base of the stem and the presence of cankers were the predominant symptoms. The pathogen dose used established a linear relationship between symptom occurrence and sclerotia dose, described by the equation: % PCS = 7.00 + 170.16 * D (g). A significant negative correlation of -0.40 (p = 0.0144) was observed between stem fresh weight and dose of the pathogen. Conclusion. The results obtained indicate that the minimum inoculum dose of 0.163 g of sclerotia can induce disease expression in the soybean crop.
Keywords: Glycine max; Sclerotium rolfsii; severity; soil fungi; bioassay.
Introducción
La soja (Glycine max (L.) Merr.) es un cultivo oleaginoso originario de China (Hou et al. 2023, Hymowitz 1990, Zhao y Gai 2004) con una gran producción a nivel mundial. Según los datos obtenidos por la FAO (2022), se produjeron 348,8 millones de toneladas de grano, donde los primeros países productores son Brasil, Estados Unidos, Argentina, China e India (FAOSTAT 2022). Este cultivo posee grandes propiedades nutritivas con un alto contenido de proteínas, que lo convierte en una fuente fundamental para la alimentación humana y animal (Nair et al. 2023, Wandkar et al. 2012).
Argentina se posiciona entre los principales cultivos nacionales. Su importancia radica en la amplia diversidad de productos que pueden obtenerse desde su producción primaria hasta su transformación en diversos productos con alto valor agregado. La cosecha de soja en las últimas cinco campañas tuvo un rendimiento promedio de 41,8 millones de toneladas de grano, con un rendimiento medio nacional de 2.655 kg ha-1 y una superficie sembrada de 16,7 millones de hectáreas (BCBA 2024). Los grupos de madurez más empleados en las regiones productoras del país en la Campaña 2023-2024 fueron el grupo IV (50,65%) seguido por los grupos V (22,89%) y VI (11,11%) (INASE 2024).
La sanidad del cultivo es fundamental para garantizar altos rendimientos y calidad de granos. Las enfermedades fúngicas pueden afectar diferentes etapas del cultivo o trasladarse en las semillas y ocasionar grandes mermas de rendimiento por muerte de plantas, disminución de la calidad de los granos o pérdidas de estos (Carmona et al. 2015, Hosseini et al. 2023, Lavilla y Ivancovich 2021). Además, factores ambientales como el déficit hídrico en el suelo o su exceso y temperaturas subóptimas en siembras tempranas pueden afectar negativamente en la germinación e incrementar su susceptibilidad al ataque de hongos y saprófitos habitantes del suelo (Ivancovich y Lavilla 2015).
Entre los patógenos de importancia agronómica se encuentra Agroathelia rolfsii (Sacc.) Redhead & Mullineaux (anamorfo Sclerotium rolfsii), un hongo polífago responsable de la pudrición del tallo y marchitez vascular, cuyos daños ocasionan disminuciones en el número de plantas y detrimentos de la producción (Fauzi y Sari 2022, Hiremath et al. 2022). Este patógeno puede afectar a más de 500 especies vegetales y se desarrolla preferentemente bajo condiciones de alta temperatura, humedad relativa y lluvias frecuentes (Bhamra y Borah 2022; Sobrinho y Santos 2021).
Las pérdidas que puede ocasionar oscilan entre el 10 y 25% en condiciones normales y pueden ser superiores al 50-80% en ataques severos, cuando las condiciones ambientales favorecen el óptimo desarrollo de la enfermedad (Bhamra y Borah 2022, Fauzi y Sari 2022, Hiremath et al. 2024).
La relevancia de esta enfermedad en el cultivo de soja ha aumentado debido a su creciente expansión en diversas regiones productoras, entre ellas China (Zheng et al. 2021), India (Bhamra y Borah 2022), Indonesia (Fauzi y Sari 2022) y Brasil (Silva et al. 2025).
A. rolfsii se caracteriza por no producir esporas ni estructuras sexuales con frecuencia, se multiplica a partir de esclerocios, estructuras de resistencia y supervivencia que produce en gran cantidad y permiten que el hongo sobreviva por largos períodos de tiempo, incluso, en ausencia de hospedantes susceptibles (Abo-Zaid et al. 2021, Ali et al. 2020, Smith et al. 1989).
Los síntomas iniciales de infección incluyen clorosis foliar y lesiones en la base del tallo próximas a la línea de suelo (Bhamra y Borah 2022, Sharf et al. 2021). Esto conduce a un rápido marchitamiento de la planta, fase en la cual se hace visible el micelio blanco del hongo (Paul et al. 2023). A medida que la enfermedad progresa, el patógeno puede producir necrosis en los tejidos vegetales y finalmente la muerte de la planta (Ali et al. 2020, Mishra et al. 2021).
La erradicación del patógeno se dificulta con métodos convencionales de control, que si bien pueden ser efectivos, frecuentemente requieren altas dosis de fungicidas de síntesis química y tienen la desventaja de ser poco persistentes, generar resistencias y ocasionar impactos negativos en el ambiente (Sharf et al. 2021, Fauzi y Sari 2022, Silva et al. 2025). Sin embargo, pueden ser una herramienta en el manejo integrado de plagas.
Paralelamente, existen avances en el empleo de alternativas biológicas mediante la utilización de microorganismos biocontroladores como Trichoderma spp. (Alonso Reyes et al. 2002, Ali et al. 2020, Müller 2021), Penicillium oxalicum (Javaid et al. 2020), Streptomyces cellulosae Actino 48 (Abo-Zaid et al. 2021), Bacillus megaterium y Pseudomonas fluorescence (Sharf et al. 2021), entre otros, debido a que son más seguros y amigables con el ambiente, los animales y las personas (Abo-Zaid et al. 2021, Javaid et al. 2020).
El manejo de la enfermedad presenta un gran desafío, debido a la falta de métodos específicos para la inoculación del patógeno bajo condiciones controladas que permitan desarrollar alternativas de control para reducir su impacto (Nogueira et al. 2019).
Por lo tanto, el objetivo del presente trabajo se centra en establecer una metodología de inoculación eficiente y reproducible de A. rolfsii en G. max, que permita determinar la dosis mínima de esclerocios necesaria para la expresión de la enfermedad.
Materiales y métodos
Los bioensayos fueron llevados a cabo en el Laboratorio de Fitopatología del Instituto Fitotécnico Santa Catalina [IFSC], ubicado en la ciudad de Llavallol, provincia de Buenos Aires (-34.79039440627301, -58.44894091003829), entre junio y septiembre del 2023.
Determinación de viabilidad de esclerocios de A. rolfsii
Para determinar la dosis mínima necesaria para inducir la enfermedad, se empleó un aislamiento de A. rolfsii obtenido de un cultivo local de lechuga realizado en el IFSC durante el 2018. El patógeno se multiplicó en semillas de trigo previamente esterilizadas. Los esclerocios obtenidos se secaron y se preservaron en bolsas selladas herméticamente antes de su conservación en cámara de refrigeración a 5 °C.
El primer ensayo consistió en determinar la viabilidad del patógeno. Para ello, se seleccionaron de forma aleatoria 50 esclerocios que fueron desinfestados en alcohol 70º e hipoclorito de sodio al 2% (Cl 35 g l-1). Posteriormente, se sembraron 5 esclerocios por placa de 9 mm de diámetro en medio agar-papa-dextrosa (APD) al 2% y se incubaron en cámara de crecimiento a 25° ± 2 °C con 12/12 h de luz/oscuridad. Se realizaron observaciones visuales cada 24 h y porcentaje de germinación se determinó a las 96 h.
Para establecer los gramos necesarios para infectar plantas de soja, se tomaron como referencia 3 dosis utilizadas por Müller (2021) en cultivo de tomate. En dicho trabajo, la máxima mortandad de plantas se obtuvo con 0,150 g esclerocios. Las dosis de referencia fueron: T1: sin esclerocios, T2: 0,075 g esclerocios, T3: 0,150 g esclerocios, T4: 0,225 g esclerocios.
Los gramos finales de esclerocios para cada tratamiento se ajustaron en función del 46% de germinación obtenido en el ensayo de viabilidad para asegurar la cantidad efectiva de inóculo viable. Las dosis ajustadas del patógeno aplicadas en los tratamientos fueron:
- T1: sin esclerocios.
- T2: 0,163 g esclerocios.
- T3: 0,326 g esclerocios.
- T4: 0,489 g esclerocios.
Inoculación del patógeno en el cultivo
Se emplearon bandejas de germinación de 20 x 25 x 9 cm con 25 celdas de 125 cc de volumen, para la siembra. El suelo utilizado, sin historial de aplicación de productos químicos, se mezcló con arena de río en proporción 2:1 respectivamente. Posteriormente, se esterilizó en autoclave a 1 atmósfera y 121 ºC durante 1 h, por triplicado.
Se utilizaron semillas de soja correspondientes al Grupo de Madurez IV corto susceptibles a la enfermedad. Estas se desinfestaron con hipoclorito de sodio al 2% (Cl 35 g l-1) durante 60 segundos, seguido de un triple enjuague con agua destilada estéril antes de la siembra.
Cada tratamiento de esclerocios se mezcló con 70 gramos de suelo (cantidad previamente estimada) para lograr una profundidad de siembra de 3 cm. Se sembraron 2 semillas por celda para cada tratamiento.
Las bandejas fueron trasladadas a una cámara de crecimiento con temperatura y luz controlada de 25° ± 2 °C y 12/12h luz/oscuridad. Se mantuvo la humedad del suelo para evitar estrés en las plantas. En post emergencia, se realizó un raleo para dejar una plántula por celda. Se efectuaron observaciones cada 24 h hasta el momento del descalce, con el fin de mantener la humedad del cultivo, registrar su estado sanitario y monitorear la aparición de signos del patógeno.
Prueba de patogenicidad de Agroathelia rolfsii
Se efectuaron cortes de tallo a la altura del cuello de las plantas donde se observaron presencia de necrosis o cancros, para determinar si los síntomas hallados correspondían al patógeno. Los mismos se desinfestaron con alcohol 70° por 30 segundos, seguido de hipoclorito de sodio al 2% (35g Cl l-1) durante 60 segundos y se enjuagaron por triplicado con agua destilada estéril. La siembra se realizó en placas de Petri con medio APD al 2%. Se llevaron a cámara de crecimiento a 25° ± 2 °C y 12/12h en luz/oscuridad. Se observaron las placas cada 24 h y la determinación del patógeno presente se efectuó a las 96 h mediante la observación visual del crecimiento del micelio del hongo y la identificación microscópica de las estructuras hifales.
Observación de síntomas en las plantas de soja
A la sexta semana de la siembra, se efectuó el descalce de las plantas para la observación visual de necrosis o cancros en el cuello del tallo.
El grado de severidad se evaluó mediante la escala de severidad de Sherwood y Hagedorn (1958), la cual describe:
- 0 = planta sana, sin síntomas.
- 1 = síntomas leves en la base del tallo con cambios en la coloración del tejido.
- 2 = colonización en el cuello del tallo, con aplanamiento del tejido, presencia de cancro.
- 3 = pérdida de turgencia en la base del tallo con aspecto anguloso.
- 4 = estrangulamiento en la base del tallo, muerte de la planta (damping off).
Adicionalmente, se midió peso fresco de la parte aérea y de la raíz de las plantas para cada tratamiento.
El diseño experimental correspondió a un diseño completamente aleatorizado (DCA) con 4 tratamientos y 3 repeticiones. Cada celda de las bandejas de germinación se consideró una unidad experimental, se utilizaron cinco celdas por cada combinación de tratamiento-repetición.
Los datos se analizaron mediante análisis de varianza (ANDEVA). La comparación de medias se realizó con test de LSD Fisher con una significancia del 95% (p < 0,05). Los grados de severidad se analizaron mediante una Tabla de contingencia (Chi Cuadrado de Pearson con un p < 0,05). A su vez, se llevó a cabo una regresión lineal para analizar la relación entre la expresión de la enfermedad y la dosis del inóculo. La relación entre la expresión de los síntomas y los pesos frescos de los órganos aéreos y raíces se determinó por medio de una correlación de Spearman.
Todos los datos cumplieron con los supuestos de normalidad y homocedasticidad. Los resultados fueron analizados con el programa estadístico Infostat (Di Rienzo et al. 2020).
Resultados
Viabilidad de esclerocios y prueba de patogenicidad de A. rolfsii
El recuento de esclerocios germinados se realizó 120 horas post siembra, observándose un 46% de germinación. Al momento del descalce, se realizaron observaciones visuales en la zona basal de los tallos de las plantas de todos los tratamientos. Las plantas del tratamiento sin esclerocios no presentaron síntomas. En contraste, las plantas de los tratamientos con diferentes dosis de esclerocios presentaron lesiones con diferentes grados de severidad predominando los cambios de coloración del tejido (Figura 1). Para confirmar la presencia del patógeno, se realizaron cortes de tallo de aquellas fracciones que presentaron necrosis o cancros y se incubaron en medio de cultivo APD para el aislamiento.
Los síntomas observados en los diferentes tratamientos se cuantificaron según la escala de Sherwood y Hagedorn (1958). Se calculó la frecuencia de plantas para cada grado de severidad en cada tratamiento. Los datos fueron expresados en porcentajes para su visualización (Tabla 1). La asociación entre los tratamientos y la distribución de los grados de severidad de la enfermedad se analizó mediante una tabla de contingencia y la prueba de Chi Cuadrado de Pearson, el cual reveló diferencias significativas entre los tratamientos (X2 = 20,55, gl = 6, p = 0,0022) considerando una significancia del 5%.

Figura 1. Observaciones visuales de los síntomas en el cuello del tallo de plantas de soja causadas por A. rolfsii. (A) Vista macroscópica de la sintomatología; (B) Detalle con lupa de la necrosis del tallo.
Figure 1. Visual observations of symptoms on the stem collar of soybean plants caused by A. rolfsii. (A) Macroscopic view of symptomatology; (B) Close-up of stem necrosis (B).
Expresión de síntomas, severidad e incidencia de la enfermedad
A lo largo de los días, se observó el crecimiento de micelio blanco en la superficie del suelo alrededor de los tallos de las plantas (Figura 2).
La comparación de medias de los tratamientos reveló diferencias significativas con un alto grado de ajuste (R2 = 0,91). Los tratamientos 3 (0,326 g) y 4 (0,489 g) indujeron la enfermedad en el 70 y 82% de las plantas, respectivamente (Figura 3). Estos tratamientos incrementaron la proporción de plantas sintomáticas en un 28,3% y un 41,6%, en comparación al Tratamiento 2 (0,163 g). En cuanto a la expresión de la enfermedad, predominaron los grados de severidad 1 y 2. El grado 1 se caracterizó por síntomas de necrosis en la base del tallo, mientras que el grado 2 presentó la formación de cancros.

Figura 2. Micelio de A. rolfsii en la superficie del suelo de plántulas de soja infectadas (A y B) y esclerocios visibles en la superficie de suelo (C).
Figure 2. Mycelium of A. rolfsii on the soil surface of infected soybean seedlings (A and B) and sclerotia visible on the soil surface (C).
Tabla 1. Distribución porcentual de los grados de severidad de la enfermedad y el porcentaje total de plantas de soja con síntomas para cada tratamiento.
Table 1. Percentage distribution of disease severity grades and total percentage of soybean plants with symptoms for each treatment.
|
Tratamiento |
|
Grado de severidad |
|
Total PCS (%) |
||||||||
|
|
|
0 |
|
1 |
|
2 |
|
3 |
|
4 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
T1 |
|
100 |
|
- |
|
- |
|
- |
|
- |
|
0 |
|
T2 |
|
64 |
|
21 |
|
14 |
|
- |
|
- |
|
35 |
|
T3 |
|
31 |
|
62 |
|
8 |
|
- |
|
- |
|
70 |
|
T4 |
|
18 |
|
73 |
|
9 |
|
- |
|
- |
|
82 |
|
Grados de severidad: 0 = planta sana. 1 = síntomas leves (necrosis) en la base del tallo. 2 = presencia de cancro. 3 = pérdida de turgencia en la base del tallo. 4 = planta muerta (damping off). PCS % = porcentaje total de plantas con síntomas. Tratamientos: T1: sin esclerocios. T2: 0,163 g de esclerocios. T3:0,326 g de esclerocios. T4: 0,489 g de esclerocios. Chi Cuadrado de Pearson = 20,55, gl =6, p = 0,0022.
Degrees of severity: 0 = healthy plant. 1 = mild symptoms (necrosis) at the base of the stem. 2 = presence of canker. 3 = loss of turgor at the base of the stem. 4 = dead plant (damping off). PCS (%) = total percentage of plants with symptoms. Treatments: T1: no sclerotia. T2: 0.163 g of sclerotia. T3: 0.326 g of sclerotia. T4: 0.489 g of sclerotia. Pearson's Chi-square = 20.55, gl = 6, p = 0.0022. |
||||||||||||
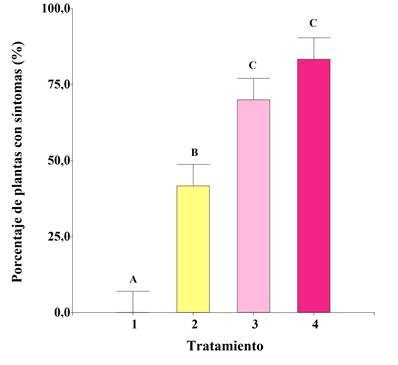
Figura 3. Porcentaje total de plantas con síntomas de la enfermedad y sus diferentes grados de incidencia según el tratamiento. T1: sin esclerocios. T2: 0,163 g de esclerocios. T3: 0,326 g de esclerocios. T4: 0,489 g de esclerocios. Letras diferentes indican diferencias significativas según la prueba de LSD Fisher (p < 0,05). Barras de error representan el error estándar.
Figure 3. Total percentage of plants with disease symptoms and their different degrees of incidence according to treatment. T1: no sclerotia. T2: 0.163 g of sclerotia. T3: 0.326 g of sclerotia. T4: 0.489 g of sclerotia. Different letters indicate significant differences according with Fisher’s LSD test (p < 0.05). Error bars represent the standard error.
La relación entre la expresión de la enfermedad y la dosis del inóculo del patógeno (expresado en g) se determinó mediante un análisis de regresión lineal. Se obtuvo una relación de tipo lineal (Figura 4) entre la dosis de esclerocios (Tratamiento) y la presencia de los síntomas en las plantas de soja.
La ecuación de regresión obtenida fue:
![]()
Donde:
% PCS = % Plantas con síntomas D = Dosis de esclerocios en gramos (g) (Tratamiento).
El grado de ajuste fue elevado (R2 = 0,87), con un p = < 0,0001. Estos resultados indican una respuesta lineal significativa entre las dosis de esclerocios (g) y el porcentaje de plantas con síntomas, considerando un nivel de significancia del 5%.
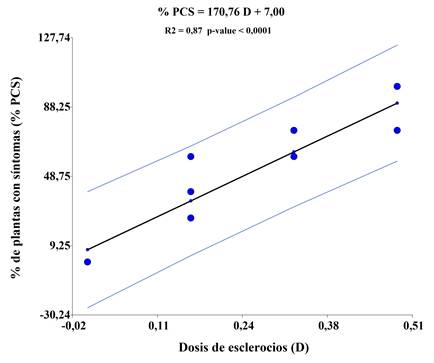
Figura 4. Curva de regresión lineal entre la dosis de esclerocios de A. rolfsii y la incidencia de la enfermedad en plantas de soja. La línea central representa la línea de ajuste, las líneas laterales corresponden a las bandas de predicción superior e inferior. p < 0,0001.
Figure 4. Linear regression curve between A. rolfsii sclerotia dose and disease incidence on soybean plants. The central line represents the fitted line, the side lines correspond to the upper and lower prediction bands. p < 0.0001.
Para determinar la relación entre el peso fresco de la parte aérea y de las raíces con la presencia de síntomas de la enfermedad, se efectuó un análisis de correlación de Spearman (Tabla 2).
Este determinó una correlación negativa significativa de -0,40 entre el peso fresco del tallo y la presencia de síntomas (p = 0,0144). A su vez, se determinó una asociación positiva y altamente significativa de +0,78 entre el peso fresco del tallo y el de la raíz (p < 0,0001).
Tabla 2. Análisis de Correlación de Spearman entre el peso fresco de la parte aérea (g) y la radicular (g) con la presencia de síntomas de la enfermedad (necrosis o cancros) en plantas de soja.
Table 2. Spearman correlation analysis between aerial (g) and root (g) fresh weight with the presence of disease symptoms (necrosis or cankers) in soybean plants.
|
|
|
PFT (g) |
|
PFR (g) |
|
PCS |
|
|
|
|
|
|
|
|
|
PFT (g) |
|
- |
|
0,78* |
|
-0,40* |
|
|
|
|
|
|
|
|
|
PFR (g) |
|
0,78* |
|
- |
|
-0,24ns |
|
|
|
|
|
|
|
|
|
PCS |
|
-0,40* |
|
-0,24ns |
|
- |
|
PFT: peso fresco del tallo, PFR: peso fresco de raíz PCS: plantas con síntomas. *= correlación significativa (p < 0,05), ns = correlación no significativa.
PFT: fresh weight of stem, PFR: fresh weight of root, PCS: plants with symptoms. *= significant correlation (p < 0.05), ns = non-significant correlation. |
||||||
Discusión
Viabilidad de esclerocios y metodología de inoculación
La supervivencia y la tasa de germinación del 46% de los esclerocios, hallada en este trabajo, reflejan la alta viabilidad de A. rolfsii, característica confirmada por estudios previos (Abo-Zaid et al. 2021, Ali et al. 2020). Chet (1975) demostró que la estructura de los esclerocios con altas reservas internas de nutrientes y polisacáridos en vesículas, junto con elevadas concentraciones de melanina en su parte externa, les confiere una prolongada supervivencia y resistencia a la degradación biológica, química y al ataque de otros hongos.
A pesar de la diversidad de métodos de inoculación existente, pocos autores han empleado los esclerocios como fuente de inóculo con un enfoque en la cuantificación de la dosis necesaria. El presente trabajo buscó representar la severidad a campo mediante el uso de esclerocios del patógeno. Sobrinho y Santos (2021) realizaron un tratamiento similar en Vigna unguiculata (L.) Walp., en su estudio, buscaron determinar la forma y concentración más adecuada para inducir la enfermedad sin dañar a las semillas, la inoculación con esclerocios ocasionó la mayor expresión de la enfermedad. Sin embargo, otros autores han aplicado diferentes métodos de inoculación con distintos objetivos.
En investigaciones sobre Arachis hypogaea (L), Bennett (2020) evaluó la resistencia de las plantas mediante el empleo de bocados de APD con micelio del hongo. Esta técnica implica colorcar un trozo de medio de cultivo colonizado con el patógeno cerca de la planta para la liberación controlada del inóculo micelial. De manera similar, Abo-Zaid et al. (2021) utilizaron la misma técnica de inoculación para evaluar el efecto antagónico de aislados actinobacterianos de S. cellulosae Actino 48 contra A.rolfsii.
Por otro lado, Ali et al. (2020) utilizaron semillas de mijo perla inoculadas con el patógeno para evaluar el antagonismo de T. harzianum y T. viride en el cultivo de Cicer arietinum (L.) var Noor 2009. Esta técnica, que consiste en cubrir las semillas de mijo perla con el patógeno para aplicarlas como tratamiento, busca asegurar una distribución uniforme del inóculo en la zona radicular. De forma análoga, Javaid et al. (2020) emplearon la misma técnica para evaluar el antagonismo del patógeno con P. oxalicum en Capsicum annuum (L.). Sharf et al. (2021) también adoptaron esta metodología con el fin de evaluar el antagonismo de bacterias PGPR y una maleza alelopática en el mismo cultivo.
Adicionalmente, Paul et al. (2023) llevaron a cabo su investigación para caracterizar a A. rolfsii extraído de Phaseolus vulgaris (L.), morfologica y molecularmente, determinar las condiciones óptimas de crecimiento, la formación de esclerocios y evaluar el rango de hospedantes mediante la utilización de semillas de trigo como fuente de inóculo. Por su parte, Mishra et al. (2021) aplicaron diferentes tratamientos inoculados (bocados de APD, semillas de trigo y palillos de dientes) en Lens culinaris Medik. para evaluar pruebas de patogenecidad y la eficacia de cada uno de ellos.
Si bien estas técnicas lograron la expresión de la enfermedad, no tuvieron por objetivo principal determinar la dosis necesaria de esclerocios para ocasionar o cuantificar la expresión de la enfermadad en los cultivos.
Expresión de síntomas y patogenecidad de A. rolfsii
La confirmación de la patogenicidad de A. rolfsii en las secciones de tallos muestreados a las 96 h de la siembra reafirma que el patógeno inoculado fue el causante de la sintomatología. Estos hallazgos coinciden con ensayos realizados por Zheng et al. en 2021 en inoculaciones sobre el mismo cultivo.
Las observaciones visuales de los síntomas en las plantas de soja, así como la confirmación de la patogenecidad de A. rolfsii a partir de las secciones de tallos muestreadas, son consistentes con la etiología de la podredumbre blanca. En las observaciones diarias, se registró un signo característico de la infección por A. rolfsii, como el crecimiento de micelio blanco en la superficie del suelo (Bhamra y Borah 2022, Carmona et al. 2015, Rivera et al. 2018).
Todos los tratamientos con dosis de esclerocios presentaron el síntoma característico de lesión en la zona basal con diferente grado de severidad. Estas lesiones pueden variar entre ablandamientos, hundimientos o lesiones que se tornan marrones, hasta clorosis de las hojas basales y rápido marchitamiento general (Bhamra y Borah 2022, Rivera et al. 2018, Sharf et al. 2021, Zheng et al. 2021).
Relación dosis-respuesta e incidencia de la enfermedad
Los resultados obtenidos en el análisis de contingencia, que revelaron diferencias significativas en la distribución de la severidad entre tratamientos (X2 = 20,55, gl = 6, p = 0,0022), indican que las diferentes dosis de esclerocios de A. rolfsii indujeron patrones de enfermedad significativamente distintos. La comparación de medias fue complementaria, al demostrar diferencias significativas en los porcentajes de plantas sintomáticas (R2 = 0,91). La evidencia obtenida demuestra que las dosis más elevadas de esclerocios (T3: 0,326 g y T4: 0,489 g) causaron una alta incidencia de la enfermedad en las plantas, lo que contrasta significativamente con el tratamiento sin patógeno, el cual no presentó síntomas. Predominaron los grados de severidad 1 (síntomas de necrosis en la base del tallo) y 2 (presencia de cancros). Estos hallazgos coinciden con las observaciones de Paul et al. (2023), quienes reportaron lesiones hundidas de coloración marrón en Phaseolus vulgaris (L.).
La relación directa y lineal entre la dosis de esclerocios y la presencia de síntomas en las plantas de soja, cuantificada por la ecuación de regresión (% PCS = 7,00 + 170,16 * D (g)), permite predecir la incidencia de la enfermedad en las plantas de soja en función de la dosis del inóculo. Este hallazgo valida la metodología de inoculación utilizada y la capacidad de las dosis controladas de A. rolfsii para inducir un gradiente de enfermedad reproducible en plantas de soja. La respuesta lineal concuerda con lo reportado por Alonso Reyes et al. (2002) en el cultivo de tomate, donde la dosis del patógeno generaba la muerte de plántulas. Sin embargo, Müller (2021) reportó una curva de tipo logarítmica en el mismo cultivo con las dosis estudiadas.
Impacto de la enfermedad en el peso fresco de la planta
La correlación negativa significativa de -0,40 entre el peso fresco del tallo y la presencia de síntomas (p = 0,0144) sugiere que, a medida que la enfermedad progresa, hay una diminución del peso fresco del tallo. Esto podría indicar un impacto en el pasaje de nutrientes y en el desarrollo de la parte aérea de la planta.
Los hallazgos de síntomas y su impacto en el crecimiento coinciden con los observados por Zheng et al. (2021), quienes reportaron crecimiento de micelio blanquecino en el cuello plantas de soja inoculadas con un aislado de A. rolfsii extraído del mismo cultivo a campo, lo que afectó su crecimiento. A su vez, la asociación positiva entre el preso fresco del tallo y el de la raíz (+0,78, p < 0,0001) refleja la estrecha conexión entre el crecimiento del tallo y las raíces, fundamental para el crecimeinto de la planta, incluso aquellas afectadas por la enfermedad.
Conclusiones
El presente estudio estableció una metodología reproducible para la inoculación de A. rolfsii en el cultivo de soja. Se requirió una dosis mínima de 0,163 g de esclerocios para inducir la expresión de la enfermedad, demostrando una respuesta lineal entre la incidencia de la enfermedad y la dosis del inóculo en el volumen de suelo descrito. Estos hallazgos son esenciales para desarrollar bioensayos estandarizados y mejorar el manejo del patógeno.
Agradecimientos
Las personas autoras agradecen la financiación del subsidio Lomas CyT V proporcionado por la Universidad Nacional de Lomas de Zamora para el desarrollo del trabajo, a los revisores pares y a los editores de la revista que permitieron mejorar el presente trabajo.
Literatura citada
Abo-Zaid, G; Abdelkhalek, A; Matar, S; Darwish, M; Abdel-Gayed, M. 2021. Application of bio-friendly formulations of chitinase-producing Streptomyces cellulosae Actino 48 for controlling peanut soil-borne diseases caused by Sclerotium rolfsii. Journal of Fungi 7(3):167. DOI: https://doi.org/10.3390/jof7030167
Ali, A; Javaid, A; Shoaib, A; Khan, I. H. 2020. Effect of soil amendment with Chenopodium album dry biomass and two Trichoderma species on growth of chickpea var. Noor 2009 in Sclerotium rolfsii contaminated soil. Egyptian Journal of Biological Pest Control 30(1):1-9. DOI: https://doi.org/10.1186/s41938-020-00305-1
Alonso Reyes, R; Barranco Martínez, B; Gracia Rivero, G; Jiménez Montejo, G. 2002. Actividad in vivo de Trichoderma harzianum sobre Sclerotium rolfsii en plántulas de tomate. Manejo Integrado de Plagas y Agroecología (Costa Rica) 66:45-48. Disponible en https://repositorio.catie.ac.cr/handle/11554/5739
BCBA (Bolsa de Comercio de Buenos Aires, Argentina). 2024. Informe Cierre de campaña Nº 24 - Soja 2023/24. Depto. Estimaciones Agrícolas. Instituto de Estudios Económicos. Bolsa de Cereales. Consultado feb. 2025. Disponible en https://www.bolsadecereales.com/estimaciones-informes
Bennett, RS. 2020. Growth chamber assay for evaluating resistance to Athelia rolfsii. Peanut Science 47(1):25-32. DOI: https://doi.org/10.3146/PS19-12.1
Bhamra, GK; Borah, M. 2022. A review on collar rot disease of soybean caused by Sclerotium rolfsii Sacc. International Journal of Economic Plants 9:235-239. Disponible en http://ojs.pphouse.org/index.php/IJEP/article/view/4744
Carmona, MA; Gally, ME; Grijalba, PE; Sautua, FJ. 2015. Evolución de las enfermedades de la soja en la Argentina: pasado, y presente. Aportes de la FAUBA al manejo integrado. Agronomía & Ambiente 35(1). Disponible en http://agronomiayambiente.agro.uba.ar/index.php/AyA/article/view/34/33
Chet, I. 1975. Ultrastructural basis of sclerotial survival in soil. Microbial Ecology 2:194-200. DOI: https://doi.org/10.1007/BF02010439
Di Rienzo, JA; Casanoves, F; Balzarini, MG; Gonzalez, L; Tablada, M; Robledo, CW. 2020. InfoStat Ver. 2020. Centro de Transferencia InfoStat, FCA, Universidad Nacional de Córdoba, Argentina. DOI: https://www.infostat.com.ar/
FAO (Food and Agriculture Organization, Italia). 2022. FAOSTAT Base de datos de la FAO. Consultado ago. 2024. Disponible en https://www.fao.org/statistics/es
FAOSTAT. 2022. Bases de datos estadísticos. Argentina. Consultado ago. 2024. Disponible en https://www.fao.org/faostat/es/#data/QCL
Fauzi, MT; Sari, RD. 2022. Effectiveness of several plant extracts as botanical fungicides to control damping-off disease caused by Sclerotium rolfsii on soybean. In IOP Conference Series: Earth and Environmental Science 1107(1):012035. IOP Publishing. DOI: https://doi.org/10.1088/1755-1315/1107/1/012035
Hiremath, IG; Jahagirdar, S; Ashtaputre, SA; Krishnaraj, PU; Kambrekar, DN. 2022. Cultural and morphological variability among the isolates of Sclerotium rolfsii Sacc. Causing collar rot of soybean. Pharma Innovation 11(9):07-12. Disponible en https://www.thepharmajournal.com/archives/?year=2022&vol=11&issue=9&ArticleId=15879
Hiremath, IG; Jahagirdar, S; Krishnaraj, PU; Ashtaputre, SA; Kambrekar, DN; Priyanka, K. 2024. Diversity studies of Sclerotium rolfsii Sacc. Isolates associated with collar rot of soybean through molecular and biochemical approaches. Agricultural Research Communication Center 47(10):1809-1814. DOI: https://doi.org/10.18805/lr-5221
Hosseini, B; Voegele, RT; Link, TI. 2023. Diagnosis of soybean diseases caused by fungal and oomycete pathogens: existing methods and new developments. Journal of Fungi 9(5):587. DOI: https://doi.org/10.3390/jof9050587
Hou, Z; Fang, C; Liu, B; Yang, H; Kong, F. 2023. Origin, variation, and selection of natural alleles controlling flowering and adaptation in wild and cultivated soybean. Molecular Breeding 43(5):36. DOI: https://doi.org/10.1007/s11032-023-01382-4
Hymowitz, T. 1990. Soybeans: The success story. Advances in new crops. Portland, ORA, USA: Timber Press. p. 159-163.
INASE (Instituto Nacional de Semillas, Argentina). 2024. Soja 2023-2024 Sistema de Información Simplificado Agrícola. Disponible en https://www.argentina.gob.ar/sites/default/files/sisa_soja_23_24_final_web.pdf
Ivancovich, AJ; Lavilla, M. 2015. Problemas sanitarios relacionados a la germinación de la semilla de soja a campo. 2018, EEA INTA Pergamino. Disponible en https://www.sidalc.net/search/Record/oai:localhost:20.500.12123-1802
Javaid, A; Afzal, R; Shoaib, A. 2020. Biological management of southern blight of chili by Penicillium oxalicum and leaves of Eucalyptus citriodora. International Journal of Agriculture & Biology 23(1):93-102.
Lavilla, M; Ivancovich, A. 2021. Relación entre enfermedades y rendimiento de granos de soja. Agronomía Mesoamericana 32(2):479-486.
Mishra, S; Mishra, P; Mishra, AK; Singh, J. 2021. Evaluation of different inoculation techniques on pathogenicity of Sclerotium rolfsii. Pharma Innov 10:758-759. DOI: https://doi.org/10.22271/tpi.2021.v10.i3k.5876
Müller, R. 2021. Trichoderma harzianum como herramienta en el manejo integrado de enfermedades de tomate. Tesis. La Plata, Argentina, Universidad Nacional de La Plata, Facultad de Ciencias Agrarias y Forestales. 110 p. DOI: https://doi.org/10.35537/10915/129788
Nair, RM; Boddepalli, VN; Yan, MR; Kumar, V; Gill, B; Pan, RS; Wang, C; Hartman, GL; Silva e Souza, R; Somta, P. 2023. Global status of vegetable soybean. Plants 12(3):609. DOI: https://doi.org/10.3390/plants12030609
Nogueira, GDA; Silva, SGDAE; Linhares, CMDS; Ambrósio, MMDQ; Nunes, GHDS. 2019. Métodos de inoculação de Fusarium solani e Sclerotium rolfsii em meloeiro. Summa Phytopathologica 45(1):59-63. DOI: https://doi.org/10.1590/0100-5405/187147
Paul, SK; Gupta, DR; Mahapatra, CK; Rani, K; Islam, T. 2023. Morpho-molecular, cultural and pathological characterization of Athelia rolfsii causing southern blight disease on common bean. Heliyon 9(5):e16136. DOI: https://doi.org/10.1016/j.heliyon.2023.e16136
Rivera, MC; Wright, ER; Silvestro, L; Stenglein, S; Kato, A. 2018. Registro de Sclerotium rolfsii como causante de pudrición de corona y raíces de Pseudogynoxis benthamii. Revista mexicana de biodiversidad 89(3):950-953. DOI: https://doi.org/10.22201/ib.20078706e.2018.3.2187
Sharf, W; Javaid, A; Shoaib, A; Khan, IH. 2021. Induction of resistance in chili against Sclerotium rolfsii by plant-growth-promoting rhizobacteria and Anagallis arvensis. Egyptian Journal of Biological Pest Control 31:1-11. DOI: https://doi.org/10.1186/s41938-021-00364-y
Sherwood, RT; Hagedorn, DJ. 1958. Determining common root rot potential of pea fields. University of Wisconsin-Madison Agricultural Experimental Station Bulletin 531:12.
Silva, LRD; Zacaroni, AB; Cardoso, ALB; Sussel, AAB; Dianese, ADC; Pereira, AF; Mello, SCMD. 2025. Biocontrol of Sclerotinia sclerotiorum, Sclerotium rolfsii, Fusarium spp., and the agronomic performance of soybean by Trichoderma spp. Revista Ciência Agronômica 56:1-14. DOI: https://doi.org/10.5935/1806-6690.20250054
Smith, VL; Jenkins, SF; Punja, ZK; Benson, DM. 1989. Survival of sclerotia of Sclerotium rolfsii: Influence of sclerotial treatment and depth of burial. Soil Biology and Biochemistry 21(5):627-632. DOI: https://doi.org/10.1016/0038-0717(89)90055-2
Sobrinho, CA; Santos, ARB. 2021. Métodos de inoculação de Sclerotium rolfsii Sacc. em feijão-caupi. Embrapa, Comunicado Técnico 263:1-11.
Wandkar, SV; Ukey, PD; Pawar, DA. 2012. Determination of physical properties of soybean at different moisture levels. Agricultural Engineering International: CIGR Journal 14(2):138-142. Disponible en https://cigrjournal.org/index.php/Ejounral/article/view/2081/1616
Zhao, TJ; Gai, JY. 2004. The Origin and evolution of cultivated soybean [Glycine max (L) Merr]. Scientia Agricultura Sinica 37(7):954-962.
Zheng, B; He, D; Liu, P; Wang, R; Li, B; Chen, Q. 2021. Occurrence of collar rot caused by Athelia rolfsii on soybean in China. Canadian Journal of Plant Pathology 43(1):43-47. DOI: https://doi.org/10.1080/07060661.2019.1703819
