Agronomía Mesoamericana
Revisión bibliográfica
Volumen 36: Artículo 60851, 2025
e-ISSN 2215-3608, https://doi.org/10.15517/am.2025.60851
https://revistas.ucr.ac.cr/index.php/agromeso/index
Uso de la yaca (Artocarpus heterophyllus Lam.) como residuo agroindustrial en la alimentación animal: Revisión sistemática*
Use of jackfruit (Artocarpus heterophyllus Lam.) as an agroindustrial byproduct in animal feeding: A systematic review
Liliana Ortega-González1, Maricela Ayala-Martínez1, Roberto González-Tenorio1, Gerardo Manuel Nava-Morales2, Héctor Hernández-Domínguez3, Sergio Soto-Simental1
* Recepción: 14 de agosto, 2024. Aceptación: 16 de octubre, 2024. La presente revisión bibliográfica es parte del proyecto de tesis doctoral de Liliana Ortega González realizado en la Universidad Autónoma del Estado de Hidalgo.
1 Universidad Autónoma del Estado de Hidalgo, Instituto de Ciencias Agropecuarias. Tulancingo de Bravo, Hidalgo. México. or231480@uaeh.edu.mx (https://orcid.org/0000-0003-2284-8267); ayalam@uaeh.edu.mx (https://orcid.org/0000-0001-5554-218X); rtenorio@uaeh.edu.mx (https://orcid.org/0000-0001-8178-2902); sotos@uaeh.edu.mx (autor para correspondencia; https://orcid.org/0000-0002-6923-0926).
2 Universidad Autónoma de Querétaro, Facultad de Química. Cerro de las Campanas S/N, Querétaro, México. gerardomnava@gmail.com (https://orcid.org/0000-0003-4689-0419).
3 Universidad Autónoma del Estado de Hidalgo, Instituto de Ciencias de la Salud. San Agustín Tlaxiaca, Hidalgo. hector_hernandez7859@uaeh.edu.mx (https://orcid.org/0000-0001-9337-8384).
Resumen
Introducción. En la actualidad, la innovación de la industria alimentaria conlleva la generación de miles de toneladas de residuos orgánicos que afectan de manera negativa la sostenibilidad ambiental. Por ello, es importante que se tomen acciones que contribuyan a la reducción de desperdicios y aprovechen los compuestos bioactivos. Objetivo. Realizar una revisión de literatura sobre los nutrientes y compuestos bioactivos presentes en las principales partes de la yaca (cáscara, pulpa y semilla), para adicionar esta fruta en la alimentación de animales de producción. Desarrollo. Se llevó a cabo una revisión sistemática basada en artículos de carácter experimental localizados en las bases de datos ScienceDirect, Wiley, Google Académico, Scopus y Springer Link. Para ello, se utilizó una ecuación de búsqueda. Los resultados mostraron que las diferentes partes de la yaca presentan nutrientes (proteínas, hidratos de carbono, minerales) y compuestos bioactivos (polifenoles, flavonoides, polisacáridos, fenoles, etc.), que se ha logrado comprobar que tienen un efecto positivo cuando se añaden en la alimentación de animales de producción (pollos de engorde, ovejas y cabras). Conclusiones. La adición de la yaca en la alimentación de animales de producción favorece la ganancia de peso, mejora la digestibilidad, estimula el sistema inmunológico y disminuye el costo de producción del alimento.
Palabras clave: compuestos bioactivos, pequeños rumiantes, pollos, ratas.
Abstract
Introduction. Currently, food industry innovation results in the generation of thousands of tons of organic waste that negatively impacts environmental sustainability. Therefore, it is important to implement actions that contribute to waste reduction and utilize bioactive compounds effectively. Objective. To conduct a systematic literature review on the nutrients and bioactive compounds present in the main components of jackfruit (peel, pulp, and seed), to evaluate its potential incorporation into livestock feed. Development. A systematic review was conducted based on experimental articles retrieved from ScienceDirect, Wiley, Google Scholar, Scopus, and Springer Link databases. A specific search equation was employed for this purpose. Results demonstrated that different jackfruit components contain nutrients (proteins, carbohydrates, minerals) and bioactive compounds (polyphenols, flavonoids, polysaccharides, phenols, etc.) that have demonstrated positive effects when incorporated into livestock feed (broilers, sheep, and goats). Conclusions. The incorporation of jackfruit into animal feed promotes weight gain, improves digestibility, stimulates the immune system, and reduces feed production costs.
Keywords: bioactive compounds, small ruminants, poultry, rats.
Introducción
La yaca (Artocarpus heterophyllus Lam.) es considerada como una de las principales frutas autóctonas de la India (International Tropical Fruits Network, 2022), proveniente del suroeste de este país (Ranasinghe et al., 2019). Es reconocida como el fruto más grande del mundo (Lazarus et al., 2023), ya que puede llegar a pesar hasta 51 kg (Nakintu et al., 2023). Además, esta fruta recibe distintos nombres según el idioma y la región en que se encuentre. Algunos de ellos son jack, jackfruit y jak en inglés; bo luo mi en chino; jacquier en francés; jackfruchbaum y nangka en alemán; yaca y jaqueira en portugués, y árbol del pan, yaca y jaqueiro en español (National Plant Germplasm System, 2023).
El fruto está compuesto por diferentes secciones, de acuerdo con lo descrito por Cruz-Casillas et al. (2021). Presenta una cáscara con ápices de carpelo cónicos, un núcleo que forma un eje longitudinal central conectado a la corteza, así como bulbos conformados por pulpa y semilla. Las hojas, la corteza y el fruto pueden contener un exudado defensivo (Samrot & Sean, 2022).
Las propiedades nutricionales de la yaca incluyen la abundancia de aminoácidos esenciales (Konsue et al., 2023), minerales como potasio, sodio, magnesio, zinc, hierro y cobre (Adan et al., 2020), y vitamina C (Xu et al., 2015). La pulpa y la semilla destacan por su contenido de proteína, con valores de 18,35 ± 0,04 y 21,66 ± 0,31, respectivamente (Kamdem Bemmo et al., 2023). Debido a su valiosa composición nutricional, se ha considerado su aprovechamiento para reducir los problemas de malnutrición que afectan algunas de las regiones de Camerún (Kamdem Bemmo et al., 2023).
También se ha comprobado la presencia de compuestos bioactivos en esta fruta, entre los cuales destacan antioxidantes, antiinflamatorios, anticancerígenos, antidiabéticos y antivirales (Natta et al., 2023). Además, distintas partes del fruto han mostrado actividad antimicrobiana frente a diversos microorganismos (Adan et al., 2020; Chavez-Santiago et al., 2022; Samrot & Sean, 2022), así como actividad antihiperglucémica (Maradesha, Patil, Al-Mutairi et al., 2022; Maradesha, Patil, Phanindra et al., 2022). La abundancia de fitoquímicos en esta fruta abre una perspectiva para la elaboración de alimentos saludables con valor agregado (Morelos-Flores et al., 2023).
El objetivo de esta investigación fue realizar una revisión de literatura sobre los nutrientes y compuestos bioactivos presentes en las principales partes de la yaca (cáscara, pulpa y semilla), para adicionar esta fruta en la alimentación de animales de producción.
Metodología
La investigación documental se llevó a cabo entre los meses de enero y marzo de 2024. Para ello, se emplearon las instalaciones y accesos a las bases de datos de la Universidad Autónoma del Estado de Hidalgo, en el Instituto de Ciencias Agropecuarias, ubicado en la ciudad de Tulancingo, Hidalgo, México. La búsqueda de literatura se realizó siguiendo las recomendaciones de la declaración PRISMA 2020 (Page et al., 2021). Las bases de datos consultadas fueron ScienceDirect, Wiley, Google Académico, Scopus y Springer Link.
Se plantearon cuatro preguntas de investigación: (a) ¿Cuáles son las características morfológicas de las principales secciones de la yaca?; (b) ¿Cuáles son las propiedades nutricionales y los compuestos bioactivos de la yaca que se pueden aprovechar para la alimentación animal?; (c) ¿Cómo se ha utilizado y qué efecto ha tenido la inclusión de alguna sección de la yaca en la alimentación animal?, y (d) ¿Cuál es la importancia del aprovechamiento de los residuos agroindustriales? Con base en estas interrogantes, se establecieron los siguientes parámetros delimitantes: periodo de publicación (2014-2024) y tipo de documento (artículo científico). La ecuación de búsqueda fue la siguiente: ((jackfruit) AND (pulp OR seed OR peel OR latex OR leave)) AND (animal feed).
La selección de la bibliografía se llevó a cabo siguiendo el diagrama de flujo mostrado en la Figura 1. Se definieron los siguientes criterios de inclusión: artículos de investigación publicados en el periodo 2014-2024, que involucren la yaca y que describan propiedades fisicoquímicas específicas de alguna de sus partes. Como criterios de exclusión se consideraron los siguientes: documentos publicados fuera del periodo indicado, artículos que no describen propiedades específicas de la yaca o la describen como mezclas con otros ingredientes, e investigaciones que no menciona en qué parte específica de la yaca se encuentran los compuestos estudiados. Finalmente, se procedió el análisis de las publicaciones seleccionadas.
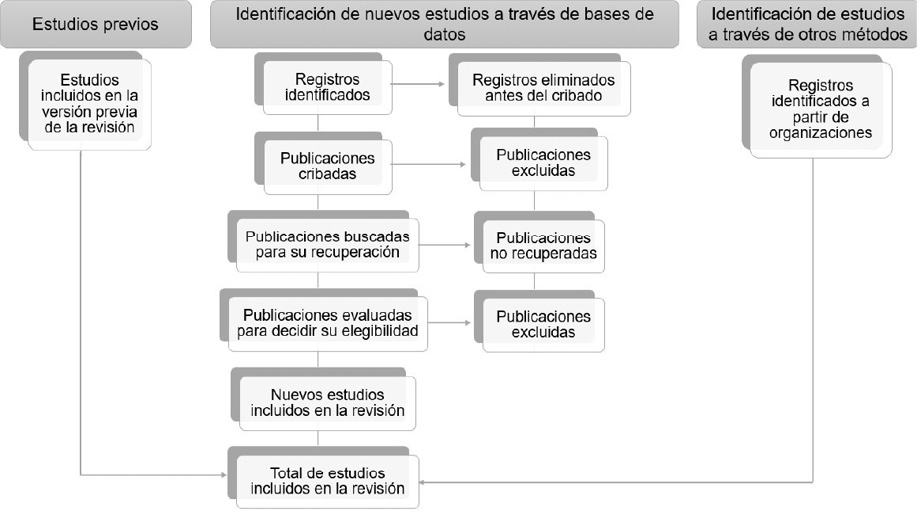
Figura 1. Diagrama de flujo para la selección de literatura en las bases de datos ScienceDirect, Wiley, Google Académico, Scopus y Springer Link, mediante el método PRISMA, en el periodo de publicación 2014-2024.
Figure 1. Flow diagram for literature selection from the ScienceDirect, Wiley, Google Scholar, Scopus, and Springer Link databases, using the PRISMA methodology, covering publications from 2014-2024.
Al realizar la búsqueda de la literatura, las bases de datos arrojaron un total de 797 documentos, de los cuales 390 fueron cribados y solo 106 fueron evaluados para decidir su elegibilidad. Sin embargo, únicamente 58 documentos cumplieron los criterios de inclusión, además se agregó información reportada por dos organizaciones internacionales (FAO and National Plant Germplasm System). En total, se utilizaron 60 fuentes de información (Figura 2).
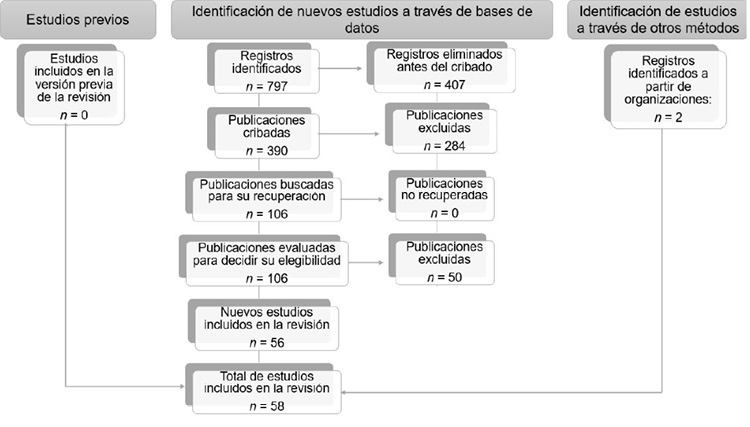
Figura 2. Resultados del número de artículos identificados durante la revisión bibliográfica en las bases de datos ScienceDirect, Wiley, Google Académico, Scopus y Springer Link, mediante el método PRISMA, en el periodo de publicación 2014-2024.
Figure 2. Results of the number of articles identified during the literature review in the ScienceDirect, Wiley, Google Scholar, Scopus, and Springer Link databases, using the PRISMA methodology, covering publications from 2014-2024.
Estadísticas de producción
En 2022, se reportó una producción anual mundial de 4 000 000 t de yaca (Food and Agriculture Organization, 2022). En 2020, solamente en la India se produjeron 1945 millones de t (International Tropical Fruits Network, 2022). Sin embargo, este fruto también se cultiva en regiones tropicales, y ya se encuentra en países como Uganda (Nakintu et al., 2023), Bangladés (Chowdhury et al., 1997), Vietnam (Thanh et al., 2021), Indonesia (Wirayudha et al., 2022), Malasia (Samrot & Sean, 2022), Kenia (Adan et al., 2020), China (Li et al., 2023) y Tailandia (Konsue et al., 2023). En América Latina, se ha registrado producción en países como Argentina, Brasil y Colombia (Informes de Expertos, 2023).
En México, el primer registro de producción de yaca data de 1993, con una tonelada en el estado de Nayarit. Desde entonces, su siembra ha aumentado y se ha expandido a otros estados como Veracruz, Jalisco, Colima, Hidalgo y Michoacán. Al cierre de la cosecha agrícola de 2022, la producción nacional de yaca fue de 36 717 t (Servicio de Información Agroalimentaria y Pesquera, 2022).
Morfología de la yaca
Los árboles de yaca pueden presentar tres regímenes de fructificación: enero-abril, mayo-agosto y septiembre-diciembre. Sin embargo, los meses de diciembre, enero y febrero son los de mayor cantidad de árboles con frutos maduros. Es importante considerar que el entorno y la variación genética del fruto influyen significativamente en los periodos de fructificación (Nakintu et al., 2023). Las características morfológicas del árbol, el fruto y el látex de la yaca se detallan en el Cuadro 1, donde se describen los rasgos principales de cada uno.
Cuadro 1. Características morfológicas de la yaca (Artocarpus heterophyllus Lam.).
Table 1. Morphological characteristics of jackfruit (Artocarpus heterophyllus Lam.).
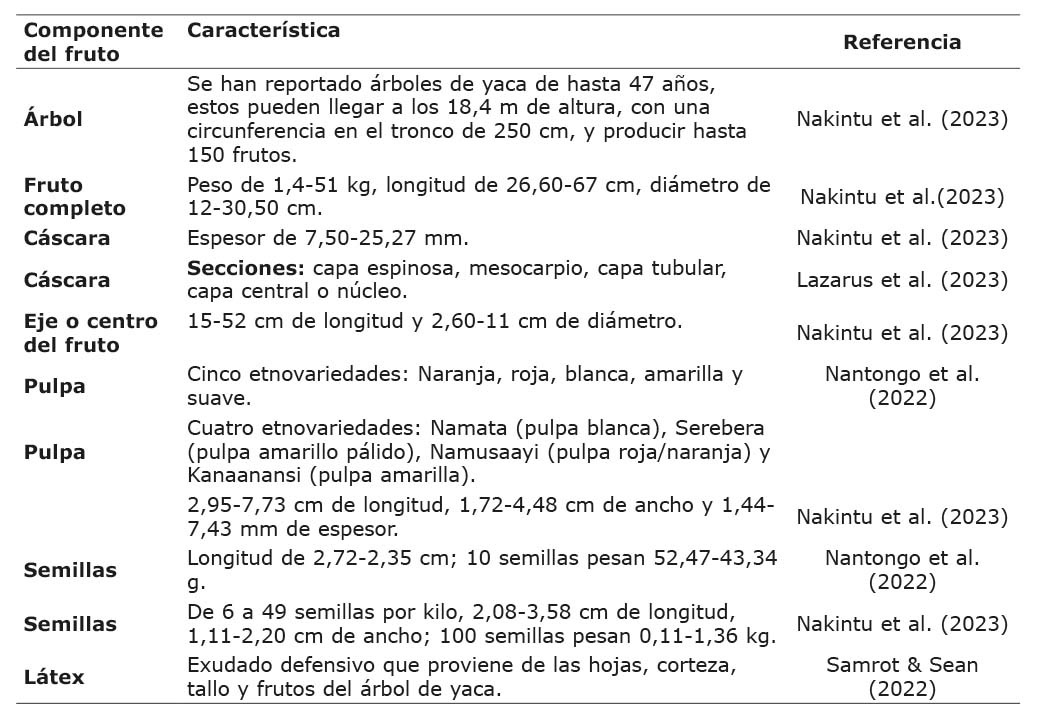
El fruto de yaca está compuesto en un 70-80 % por elementos no aptos para el consumo humano, entre los cuales se encuentran la cáscara, el perianto y el núcleo (Brahma & Ray, 2024). La cáscara ha desarrollado un conjunto de capas y un exterior espinoso que le permiten resistir los impactos de alta energía al caer de grandes alturas (25 m) cuando el fruto ya está maduro. Este exterior espinoso está conectado a células parenquimatosas más blandas que forman un compuesto reforzado con fibras. La capa con mayor contenido de lignina es el mesocarpio, mientras que el núcleo es el segmento que contiene más pectina (Lazarus et al., 2023).
Los agricultores de diversas regiones han identificado los árboles y los frutos de yaca en distintas etnovariedades, cuyas principales diferencias son la altura del árbol, la circunferencia del tronco, el tamaño del fruto, el color de la pulpa, el tamaño de la semilla y la tasa de germinación (Nakintu et al., 2023; Nantongo et al., 2022). El tamaño de las semillas varía en longitud y ancho según la etnovariedad a la que pertenezcan. Las semillas blancas y rojas son más pequeñas que las naranjas, y las semillas de la variedad blanda tienen un mayor peso en fresco y en seco (Nantongo et al., 2022).
Tanto la planta como el fruto de la yaca presentan un exudado defensivo (Samrot & Sean, 2022), conocido como “látex”. Este ha sido considerado un residuo de la producción agrícola y actualmente no tiene aplicación en la industria farmacéutica ni alimentaria (Ramos-Martínez et al., 2022).
Características químicas de la yaca
La popularidad de la yaca se debe a los beneficios terapéuticos que se le atribuyen, lo que ha llevado a considerarlo un cultivo de seguridad alimentaria y nutricional (Nakintu et al., 2023). Las características químicas de la hoja, la cáscara, la pulpa y el látex de este fruto se han documentado y se presentan en el Cuadro 2.
Cuadro 2. Características químicas de la hoja, cáscara, pulpa y látex presentes en la yaca (Artocarpus heterophyllus Lam.).
Table 2. Chemical characteristics of leaves, peel, pulp, and latex in jackfruit (Artocarpus heterophyllus Lam.).
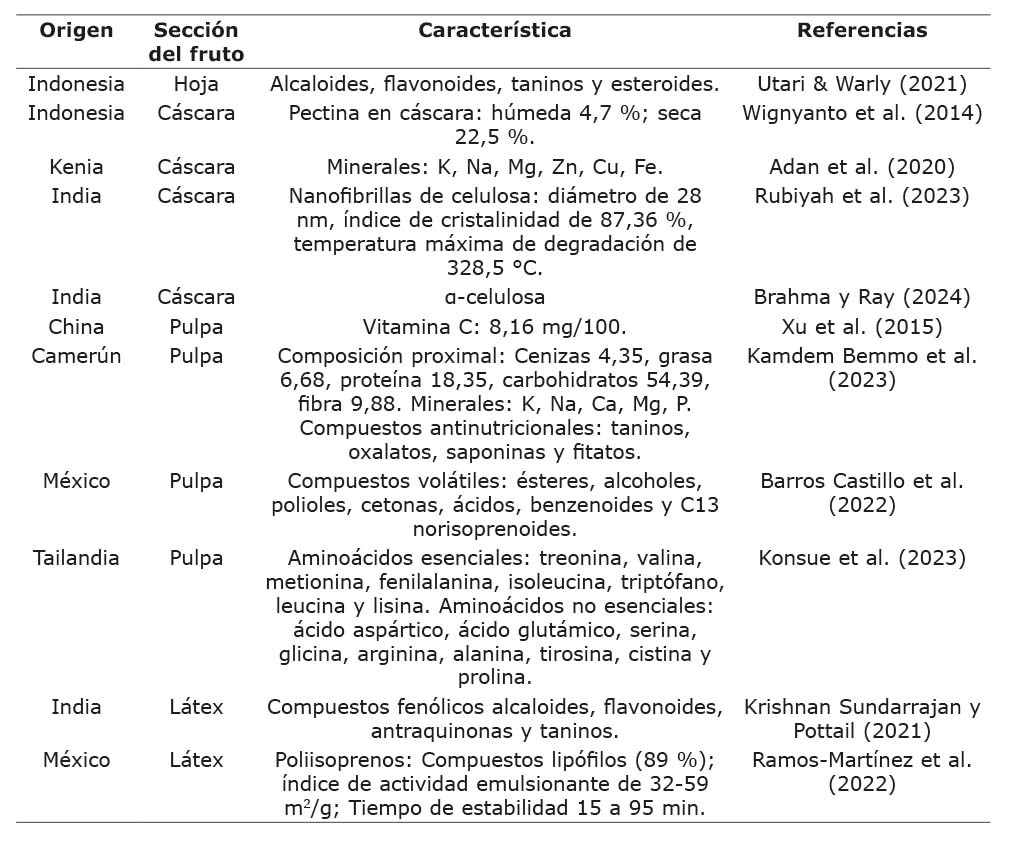
Al realizar pruebas fitoquímicas a las hojas del árbol de yaca, se comprobó la presencia de varios metabolitos secundarios como fenoles, saponinas, taninos, alcaloides, triterpenoides y flavonoides. Estos últimos actúan como pigmentos reguladores de la fotosíntesis, y como antimicrobianos y antivirus que actúan sobre los insectos (Utari & Warly, 2021). La cáscara destaca por sus propiedades gelificantes, que son similares a las pectinas de grado analítico y comercial, lo que la convierte en una alternativa para la industria alimentaria en la producción de mermeladas o suspensiones frutales similares (Begum et al., 2021). Además, se ha propuesto su uso en la elaboración de otros productos como el vino (Cagasan et al., 2021).
La presencia de nanofibrillas es prometedora para la síntesis de nanocompuestos orgánicos o inorgánicos biodegradables, o para aplicaciones catalíticas (Rubiyah et al., 2023). La extracción de celulosa de la cáscara presenta una mayor purificación en comparación con la celulosa comercial, con una mejor capacidad de retención de agua y aceite. Esto sugiere que podría ser utilizada en diversas industrias, como la alimentaria, de pintura y papelera, así como en la fabricación de películas de embalaje y productos farmacéuticos (Brahma & Ray, 2024).
En la pulpa de yaca, se han identificado más de 60 compuestos volátiles, que se pueden emplear para contribuir a la potencialización del aroma y el sabor de productos como yogur, bebidas fermentadas, mermeladas, jugos, cerveza o purés (Barros-Castillo et al., 2022). Los poliisoprenos extraídos del látex de la yaca se han caracterizado por su capacidad espumante y emulsionante, así como por su comportamiento térmico, ya que los eventos endotérmicos están asociados a la fusión del concentrado, mientras que los eventos exotérmicos se relacionan con la cristalización de los poliisoprenos. Estos extractos sugieren su uso en la preparación de emulsiones o en procesos de encapsulación (Ramos-Martínez et al., 2022).
Por otro lado, las semillas de yaca tienen propiedades con potencial para la industria alimentaria, las cuales se describen en el Cuadro 3. El almidón que contienen las semillas es similar al de los cereales (Li et al., 2019), lo que lo hace adecuado para la elaboración de alimentos que requieren altas temperaturas (Le et al., 2023). Además, se ha identificado la presencia de enzimas proteolíticas, lo cual podría contribuir a la formulación de ablandadores y conservantes de carne de manera natural (Ramli et al., 2021).
Cuadro 3. Características químicas de la semilla de yaca (Artocarpus heterophyllus Lam.).
Table 3. Chemical characteristics of jackfruit seeds (Artocarpus heterophyllus Lam.).
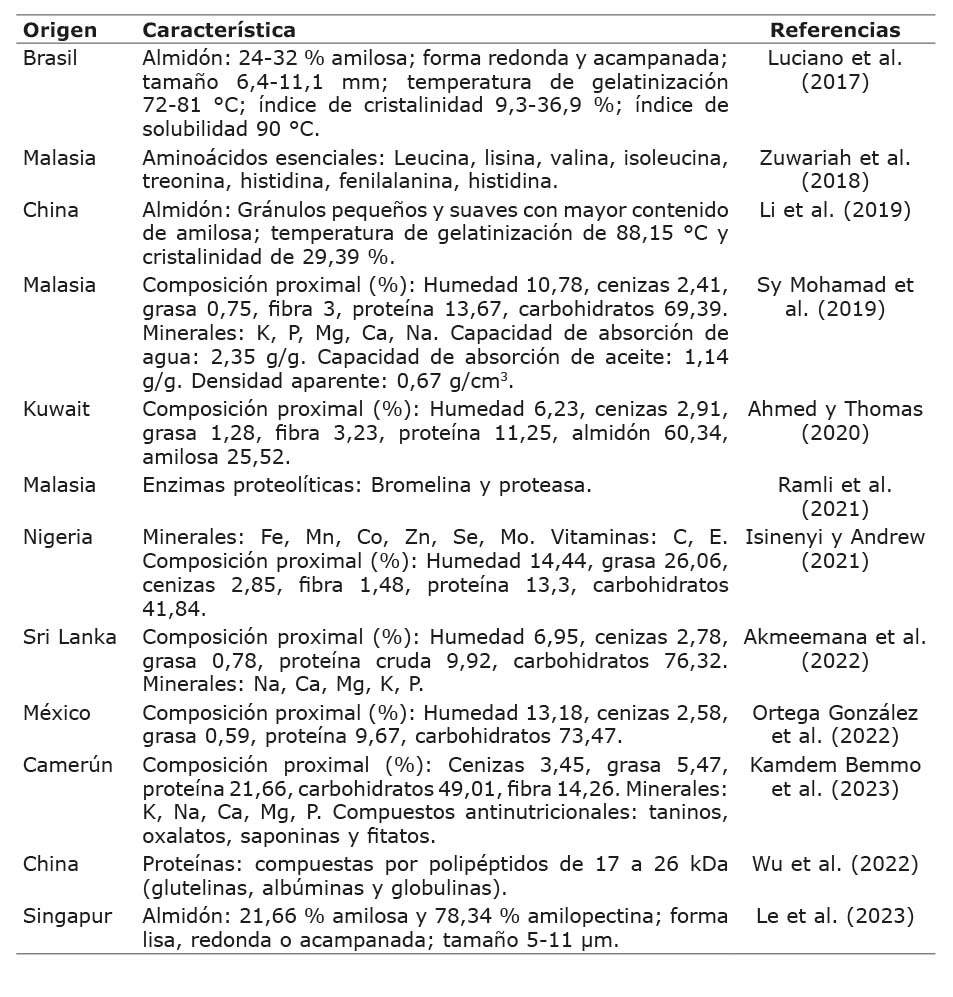
Debido a la presencia de compuestos volátiles, las semillas de yaca fermentadas mejoran el aroma del chocolate en la preparación de capuchinos (Papa Spada et al., 2018) y podrían utilizarse como aditivo con la misma finalidad en la formulación de otros alimentos (Spada et al., 2022), como los conos para helado (Kushwaha et al., 2023).
La utilización del aislado proteínico de la semilla se considera como una nueva fuente de proteína para su aplicación en sistemas alimentarios (Ulloa et al., 2017). Se sugiere que se enfoque en la elaboración de productos sin gluten o nutracéuticos, donde se requiera un control en el tamaño de la partícula para alcanzar las consistencias deseadas (Ahmed & Thomas, 2020). Además, en la panificación, se ha comprobado que la adición de esta semilla mejora la aceptabilidad sensorial de donas (Ortega-González et al., 2022). Sin embargo, es de suma importancia continuar evaluando los posibles efectos tóxicos para identificar y aislar, en el extracto crudo de la semilla, los compuestos que podrían ser responsables de dicha toxicidad (Sy Mohamad et al., 2019).
Compuestos bioactivos de la yaca (A. heterophyllus Lam.)
Al evaluar las diferentes secciones del fruto de la yaca, se ha evidenciado la presencia de compuestos bioactivos, los cuales se describen en el Cuadro 4. La mayoría de estos compuestos son fenólicos, flavonoides y polisacáridos (Adan et al., 2020; Maradesha, Patil, Al-Mutairi et al., 2022; Maradesha, Patil, Phanindra et al., 2022; Li et al., 2023). Se ha observado que el extracto de cáscara tiene una concentración más alta de fenoles en comparación con los extractos de pulpa y semilla, al haberse identificado 53 compuestos bioactivos (Zhang et al., 2017).
Cuadro 4. Actividad biológica de los compuestos bioactivos presentes en la yaca (Artocarpus heterophyllus Lam.).
Table 4. Biological activity of bioactive compounds in jackfruit (Artocarpus heterophyllus Lam.).

El contenido de compuestos fenólicos y flavonoides está inversamente relacionado con la madurez del fruto, ya que a medida que la madurez aumenta, estos compuestos disminuyen, mientras que la capacidad antioxidante incrementa. Esto podría deberse a un aumento en la cantidad de ácido galacturónico (Nidhina et al., 2022). En la pulpa de yaca, se lograron cuantificar 28 compuestos fenólicos, entre los cuales el ácido shikímico (C7H10O5) es el más abundante (Morelos-Flores et al., 2023).
El color de la pulpa de la yaca tiene diversas tonalidades, que presentan variaciones en sus propiedades. La pulpa con coloración amarillo intenso tiene un mayor contenido de compuestos antioxidantes y flavonoides, además de una mayor inhibición de la enzima α-glucosidasa. Por otro lado, la pulpa con coloración rojo-anaranjada exhibe una mayor inhibición de las enzimas β-glucosidasas y α-amilasa (Natta et al., 2023).
Se ha estudiado la actividad antimicrobiana y antioxidante de los extractos acuoso y triflouroetanol del látex de la yaca. El extracto acuoso inhibe el crecimiento de Staphylococcus aureus, Pseudomona aeruginosa y Bacillus sp., y ambos extractos tienen actividad antioxidante (Samrot & Sean, 2022). Los polisacáridos presentes en la pulpa regulan la microecología intestinal, mejoran la abundancia de bacterias productoras de ácidos grasos de cadena corta, restringen la ganancia de peso, mejoran el perfil lipídico y aumentan la capacidad antioxidante (Zeng et al., 2023). Para aprovechar de forma integral los nutrientes y los compuestos bioactivos de la yaca, se desarrolló un protocolo para la regeneración genéticamente uniforme de este fruto (Kader et al., 2022).
Utilización de la yaca (A. heterophyllus Lam.) en la alimentación animal
Los restos de muchos de los alimentos pueden utilizarse de manera más eficiente para aumentar la sostenibilidad alimentaria (Li et al., 2023). Sin embargo, una amplia gama de frutos con riqueza de nutrientes se ven amenazados por la falta de mercado para los productos frescos, la estacionalidad, la preferencia por el consumo de productos procesados y las pérdidas durante las temporadas de lluvias (International Tropical Fruits Network, 2022).
En los últimos años, el concepto de “vertido cero” ha cobrado relevancia, con la finalidad de mitigar los problemas ambientales generados por toneladas de residuos agroindustriales, como las semillas y cáscaras de muchas frutas que se desechan en el medioambiente (Antonisamy et al., 2023). El reciclaje de diferentes partes no utilizadas de las frutas puede traer beneficios como el aprovechamiento de componentes antimicrobianos en la agricultura y la reducción del impacto ambiental de los biorresiduos (Adan et al., 2020; Brahma & Ray, 2022). La acumulación de biorresiduos generados durante el procesamiento de la yaca ha sido señalada como fuente de contaminación del agua y del aire (Adan et al., 2020).
Las hojas de yaca han sido propuestas como un recurso en la alimentación animal. Se ha confirmado que estas hojas contienen altos niveles de proteína y taninos (Utari & Warly, 2021), lo que sugiere un posible aumento en la síntesis de proteína microbiana y, por tanto, una mayor productividad en rumiantes, especialmente en cabras. En otro estudio, se sustituyó el pasto pará por hojas de yaca en proporciones de 0, 50, 75 y 100 %, en la alimentación de cabras destinadas a la producción de carne. Los resultados mostraron una mejor ganancia de peso y mayor retención de nitrógeno, sin afectar la fermentación ruminal, cuando se usaron 75 y 100 % de sustitución (Thanh et al., 2021). Sin embargo, en una investigación con ovejas alimentadas con una dieta basal complementada con 700 g de hojas de yaca, no se observaron efectos significativos en la digestibilidad ni en el consumo de alimento de los animales (Wirayudha et al., 2022).
Además, se ha investigado la adición de semillas de yaca en la dieta de aves. En un estudio con pollos de engorde alimentados durante seis semanas, la inclusión del 20 % de semilla de yaca mejoró la eficiencia productiva, mientras que la adición de 30 % disminuyó dicha eficiencia (Odukwe et al., 2017). En otra investigación, se alimentaron pollos de engorde de siete días de edad con 0, 5, 10 y 15 % de semilla tostada de yaca, y se reportó que la inclusión de 5 % mejoró los costos de producción, así como el crecimiento, el rendimiento y la eficiencia alimenticia (Eburuaja et al., 2019). En gallinas de Guinea alimentadas con 0, 10, 15 y 20 % de harina de semilla de yaca, se observó que adicionar 20 % permitió alcanzar un mayor peso final y una rentabilidad económica superior (Aroh et al., 2023).
Al evaluar diferentes dietas con residuos de frutas (cáscara de piña, corona de piña, cáscara de yaca, pulpa de yaca, coco rallado y residuo de frutas mixtas) para la alimentación de tilapia roja híbrida, se comprobó que la cáscara de yaca añadida al 5 % de la dieta promovió el crecimiento y estimuló el sistema inmunológico de los peces (Sulaiman et al., 2022). Con el fin de mejorar la disponibilidad de nutrientes de la cáscara de la yaca, se ha propuesto el uso de la fermentación. En este sentido, un estudio sobre la fermentación de cáscara de yaca con Saccharomyces cerevisiae demostró que el contenido de proteína se puede incrementar hasta en un 167 % (Moisés de Sousa et al., 2020).
En otro estudio, al evaluar la fermentación del contenido ruminal in vitro utilizando cáscara de yaca y Aspergillus oryzae, se evidenció un incremento en la actividad microbiana del rumen durante la degradación del alimento, lo cual mejoró la digestibilidad de la materia orgánica y seca (Mashudi & Nurmawati, 2022). Asimismo, al alimentar cabras entre 6 y 7 meses de edad con semillas de yaca crudas, remojadas y tostadas, se observó una mejora en la ingesta de nutrientes, la digestibilidad y la utilización del nitrógeno, lo que contribuyó a mantener un equilibrio positivo de nitrógeno y un adecuado mantenimiento de los animales (Eyoh & Udo, 2020).
Las investigaciones realizadas con yaca en la alimentación de ratas han demostrado tener efectos benéficos en los niveles de bioquímica sanguínea (Agiang et al., 2017; Isinenyi & Andrew, 2021; Sabidi et al., 2020). Ratas Sprague-Dawley, machos y hembras, de seis semanas de edad, alimentadas con 4 g kg-1 de extracto fermentado de pulpa o de hoja de yaca, no presentaron signos toxicológicos y se mantuvieron saludables, según los niveles de la bioquímica sanguínea; además, después de 28 días se observó un incremento en su peso (Sabidi et al., 2020). Al suplementar ratas albinas con peso inicial entre 80 y 140 g durante 28 días, con 10, 30 y 50 % de pulpa de yaca, semilla o la combinación de ambas, se concluyó que la pulpa de yaca al 10 % posee efectos antianémicos y mejora el sistema inmunológico. Sin embargo, el consumo en exceso puede provocar alergias (Agiang et al., 2017).
En un estudio con ratas Wistar alimentadas con 40 y 60 % de semilla yaca sometida a un tratamiento de escaldado a 60 °C, se demostró que este ingrediente presenta un alto contenido de hierro y proteínas, sin generar efectos tóxicos en hígado ni riñones (Isinenyi & Andrew, 2021). Además, se comprobó que la alimentación de ratas Swiss albinas con 20 % de harina de semilla de yaca en dietas altas en sucrosa ayuda a mejorar el perfil lipídico y disminuir los niveles de glucosa en sangre, derivado de dietas altas en azúcar (Goswami et al., 2021). De manera similar, el consumo de almidón resistente obtenido de semilla de yaca, administrado a ratones C57BL/6 J alimentados con dietas altas en grasa, logró mantener la homeostasis de los microorganismos intestinales y corrigió la hiperlipidemia en simbiosis con Bifidobacterium pseudolongum (Zhang et al., 2021).
Conclusiones
Los residuos de las frutas constituyen una fuente significativa de biorresiduos que, si no se gestionan de forma adecuada, pueden provocar impactos negativos en el medioambiente. Por ello, es fundamental promover su aprovechamiento integral en el sector primario, especialmente en el caso de frutas que generan altos volúmenes de residuos, como la yaca (Artocarpus heterophyllus Lam.). De esta fruta se pueden aprovechar diversos nutrientes (proteína, fibra, hidratos de carbono, vitaminas y minerales) y compuestos activos (fenoles, antivirales, antidiabéticos y antioxidantes), para contribuir de manera positiva en la alimentación de animales de producción, como pollos de engorde, ovejas y cabras. Además, se ha evidenciado que la yaca favorece la salud del animal, estimula el sistema nervioso, mejora la digestibilidad, incrementa la ganancia de peso y, por ende, aumenta la relación costo-eficacia en los sistemas de producción.
Agradecimientos
Los autores agradecen al Consejo Nacional de Humanidades, Ciencias y Tecnologías del Gobierno de México por la beca otorgada a Ortega-González, L., para estudiar el Doctorado en Ciencias Agropecuarias (beca n.º 1002987).
Conflicto de intereses
Los autores declaran que no existe conflicto de intereses.
Referencias
Adan, A. A., Ojwang, R. A., Muge, E. K., Mwanza, B. K., & Nyaboga, E. N. (2020). Phytochemical composition and essential mineral profile, antioxidant and antimicrobial potential of unutilized parts of jackfruit. Food Research, 4(4), 1125–1134. https://doi.org/10.26656/fr.2017.4(4).326
Agiang, M. A., Dongo, B. S., Williams, I. O., & Utu-Baku, A. B. (2017). Assessment of the haematological indices of albino rats fed diets supplemented with jackfruit bulb, seed or a blend of bulb and seed. International Journal of Biological and Chemical Sciences, 11(1), 397–407. http://dx.doi.org/10.4314/ijbcs.v11i1.31
Ahmed, J., & Thomas, L. (2020). Oscillating rheology of jackfruit (Artocarpus heterophyllus) seed flour dough in relation to different particle size. Journal of Food Process Engineering, 43(12), Article e13558. https://doi.org/10.1111/jfpe.13558
Akmeemana, C., Wickramasinghe, I., Wanniarachchi, P. C., & Vithanage, T. (2022). Effect of drying and frying pre-treatments on nutrient profile, antioxidant capacity, cooking time, and sensory acceptability of easy to cook jackfruit seeds. Applied Food Research, 2(2), Article 100234. https://doi.org/10.1016/j.afres.2022.100234
Antonisamy, A. J., Marimuthu, S., Malayandi, S., Rajendran, K., Lin, Y.-C., Andaluri, G., Lee, S. L., & Ponnusamy, V. K. (2023). Sustainable approaches on industrial food wastes to value-added products – A review on extraction methods, characterizations, and its biomedical applications. Environmental Research, 217, Article 114758. https://doi.org/10.1016/j.envres.2022.114758
Aroh, I. M., Odukwe, C. N., Macartan, B. P., Agida, C. A., Ullah, K., & Archibong, B. U. (2023). Raw jackfruit (Artocarpus heterophyllus) Seedmeal: effect on growth performance, organ weight, carcass yield, and economic production of guinea fowl keets. Journal of Applied Life Sciences International, 26(4), 31–41. https://doi.org/10.9734/jalsi/2023/v26i4612
Barros-Castillo, J. C., Calderón-Santoyo, M., García-Magaña, M. L., Calderón-Chiu, C., & Ragazzo-Sánchez, J. A. (2022). Volatile compounds released by acid hydrolysis in jackfruit (Artocarpus heterophyllus Lam.). A comparative study by using SDE and HS-SPME techniques. Journal of Food Composition and Analysis, 113, Article 104701. https://doi.org/10.1016/j.jfca.2022.104701
Begum, R., Aziz, M. G., Yusof, Y. A., Saifullah, M., & Uddin, M. B. (2021). Evaluation of gelation properties of jackfruit (Artocarpus heterophyllus) waste pectin. Carbohydrate Polymer Technologies and Applications, 2, Article 100160. https://doi.org/10.1016/j.carpta.2021.100160
Brahma, R., & Ray, S. (2022). In-depth analysis on potential applications of jackfruit peel waste: A systematic approach. Food Chemistry Advances, 1, Article 100119. https://doi.org/10.1016/j.focha.2022.100119
Brahma, R., & Ray, S. (2024). Optimization of extraction conditions for cellulose from jackfruit peel using RSM, its characterization and comparative studies to commercial cellulose. Measurement: Food, 13, Article 100130. https://doi.org/10.1016/j.meafoo.2023.100130
Cagasan, C. U., Lingatong, C. A., Pore, K. M., Ramada, R., Restor, C. D., & Lauzon, R. (2021). Production and quality evaluation of wine from jackfruit co-products. International Journal of Life Sciences and Biotechnology, 4(3), 340–352. https://doi.org/10.38001/ijlsb.827739
Chavez-Santiago, J. O., Rodríguez-Castillejos, G. C., Montenegro, G., Bridi, R., Valdés-Gómez, H., Alvarado-Reyna, S., Castillo-Ruiz, O., & Santiago-Adame, R. (2022). Phenolic content, antioxidant and antifungal activity of jackfruit extracts (Artocarpus heterophyllus Lam.). Food Science and Technology, 42, Article e02221. https://doi.org/10.1590/fst.02221
Chowdhury, F. A., Raman, Md. A., & Mian, A. J. (1997). Distribution of free sugars and fatty acids in jackfruit (Artocarpus heterophyllus). Food Chemistry, 60(1), 25–28. https://doi.org/10.1016/S0308-8146(96)00294-4
Cruz-Casillas, F. C., García-Cayuela, T., & Rodriguez-Martinez, V. (2021). Application of conventional and non-conventional extraction methods to obtain functional ingredients from jackfruit (Artocarpus heterophyllus Lam.) tissues and by-products. Applied Sciences, 11(16), Article 7303. https://doi.org/10.3390/app11167303
Eburuaja, A. S., Onabanjo, R. S., Onunkwo, D. N., & Ukenye, U. S. (2019). Performance of broiler chickens fed graded dietary levels of toasted jackfruit seed meal (Artocarpus heterophyllus). Nigerian Journal of Animal Production, 46(4), 171–178. https://doi.org/10.51791/njap.v46i4.346
Eyoh, G. D., & Udoh, M. D. (2020). Effects of processed jackfruit seed based diet on nutrient intake, digestibility and nutrition in West African dwarf goats. Nigerian Journal of Animal Production, 47(5), 204–212. https://doi.org/10.51791/njap.v47i5.1271
Food and Agriculture Organization. (2022). The green development of special agricultural product-jackfruit in China. https://www.fao.org/3/cc3672en/cc3672en.pdf
Goswami, C., Kazal, M. K. H., Alam, O., Moon, R. J., Khatun, K., Hossan, M., & Chacrabati, R. (2021). Jackfruit seed powder supplementation attenuates high-sugar diet-induced hyperphagia and hyperglycemia in mice. Biology and Life Sciences Forum, 6(1), 92. https://doi.org/10.3390/Foods2021-10970
Informes de Expertos. (2023). Mercado global de jackfruit. https://www.informesdeexpertos.com/informes/mercado-de-jackfruit
International Tropical Fruits Network. (2022). Report on the international webinar on ´Developing the jackfruit for global consumption and markets´. https://www.itfnet.org/v1/wp-content/uploads/2022/07/JACKFRUIT-REPORT-WITH-eISBN.pdf
Isinenyi, G. O., & Andrew, N. (2021). Study on the nutritional compositions of boiled jackfruit seed and its effect on the liver and kidney functions of Wistar albino rats. International Network Organization for Scientific Research, 7(1), 96–108. https://www.inosr.net/wp-content/uploads/2022/01/INOSR-AP-7196-108-2021.-ISINEYI.pdf
Kader, A., Sinha, S. N., & Ghosh, P. (2022). Clonal fidelity investigation of micropropagated hardened plants of jackfruit tree (Artocarpus heterophyllus L.) with RAPD markers. Journal of Genetic Engineering and Biotechnology, 20(1), 145. https://doi.org/10.1186/s43141-022-00426-0
Kamdem Bemmo, U. L., Bindzi, J. M., Tayou Kamseu, P. R., Houketchang Ndomou, S. C., Tene Tambo, S., & Ngoufack Zambou, F. (2023). Physicochemical properties, nutritional value, and antioxidant potential of jackfruit (Artocarpus heterophyllus) pulp and seeds from Cameroon eastern forests. Food Science & Nutrition, 11(8), 4722–4734. http://doi.org/10.1002/fsn3.3437
Konsue, N., Bunyameen, N., & Donlao, N. (2023). Utilization of young jackfruit (Artocarpus heterophyllus Lam.) as a plant-based food ingredient: influence of maturity on chemical attributes and changes during in vitro digestion. LWT - Food Science and Technology, 180, Article 114721. https://doi.org/10.1016/j.lwt.2023.114721
Krishnan Sundarrajan, S., & Pottail, L. (2021). Green synthesis of bimetallic Ag@Au nanoparticles with aqueous fruit latex extract of Artocarpus heterophyllus and their synergistic medicinal efficacies. Applied Nanoscience, 11, 971–981. https://doi.org/10.1007/s13204-020-01657-8
Kushwaha, R., Gupta, A., Singh, V., Kaur, S., Puranik, V., & Kaur, D. (2023). Jackfruit seed flour-based waffle ice cream cone: optimization of ingredient levels using response surface methodology. Heliyon, 9(2), Article e13140. https://doi.org/10.1016/j.heliyon.2023.e13140
Lazarus, B. S., Leung, V., Luu, R. K., Wong, M. T., Ruíz-Pérez, S., Barbosa, W. T., Almeida Bezerra, W. B., Barbosa, J. D. V., & Meyers, M. A. (2023). Jackfruit: composition, structure, and progressive collapsibility in the largest fruit on the Earth for impact resistance. Acta Biomaterialia, 166, 430–446. https://doi.org/10.1016/j.actbio.2023.04.040
Le, T. A. N., Lee, J. J. L., & Chen, W. N. (2023). Stimulation of lactic acid production and Lactobacillus plantarum growth in the coculture with Bacillus subtilis using jackfruit seed starch. Journal of Functional Foods, 104, Article 105535. https://doi.org/10.1016/j.jff.2023.105535
Li, B., Wang, H., Wang, X., Zhang, Y., Tan, Y., Zhang, Y., Chu, Z., & Zhang, Y. (2019). Prediction of the postprandial blood sugar response estimated by enzymatic kinetics of in vitro digestive and fine molecular structure of Artocarpus heterophyllus lam seed starch and several staple crop starches. Starch - Stärke, 71(9–10), Article 1800351. https://doi.org/10.1002/star.201800351
Li, Y.-F., Wu, B., Chen, J.-P., Veeraperumal, S., Wei, J.-C., Tan, K.-S., Zhong, S., & Cheong, K.-L. (2023). Prebiotic characteristics of added-value polysaccharides from jackfruit peel waste during in vitro digestion and fecal fermentation. LWT - Food Science and Technology, 187, Article 115330. https://doi.org/10.1016/j.lwt.2023.115330
Luciano, C. G., Landi Franco, C. M., Ayala Valencia, G., Do Amaral Sobral, P. J., & Freitas Moraes, I. C. (2017). Evaluation of extraction method on the structure and physicochemical properties of starch from seeds of two jackfruit varieties. Starch - Stärke, 69(11–12), Article 1700078. https://doi.org/10.1002/star.201700078
Maradesha, T., Patil, S. M., Al-Mutairi, K. A., Ramu, R., Madhunapantula, S. V., & Alqadi, T. (2022). Inhibitory effect of polyphenols from the whole green jackfruit flour against α-glucosidase, α-amylase, aldose reductase and glycation at multiple stages and their interaction: inhibition kinetics and molecular simulations. Molecules, 27(6), Article 1888. https://doi.org/10.3390/molecules27061888
Maradesha, T., Patil, S. M., Phanindra, B., Achar, R. R., Silina, E., Stupin, V., & Ramu, R. (2022). Multiprotein inhibitory effect of dietary polyphenol rutin from whole green jackfruit flour targeting different stages of diabetes mellitus: defining a bio-computational stratagem. Separations, 9(9), Article 262. https://doi.org/10.3390/separations9090262
Mashudi, M., & Nurmawati, W. (2022). Effect of fermentation on mixed rumen contents and jackfruit peel using Aspergillus oryzae on in vitro gas production and digestibility. E3S Web of Conferences, 335, Article 00048. https://doi.org/10.1051/e3sconf/202233500048
Moisés de Sousa, A. P., Nascimento Campos, A. R., Palmeira Gomes, J., Costa de Santana, R. A., De França Silva, A. P., Buriti de Macedo, A. D., & Dantas Costa, J. (2020). Protein enrichment of jackfruit peel waste through solid-state fermentation. Revista Brasileira de Ciências Agrárias, 15(1), Article e6406. https://doi.org/10.5039/agraria.v15i1a6406
Morelos-Flores, D. A., Anzaldo-Mendiola, R. L., Montalvo-González, E., Zamora-Gasga, V. M., Chacón-López, M. A., Santacruz-Varela, A., & García-Magaña, M. L. (2023). Characterization and antioxidant capacity of phenolic compounds of jackfruit genotypes from Nayarit, Mexico. Food Chemistry Advances, 3, Article 100470. https://doi.org/10.1016/j.focha.2023.100470
Nakintu, J., Andama, M., Albrecht, C., Wangalwa, R., Lejju, J. B., & Olet, E. A. (2023). Morphological traits of jackfruit (Artocarpus heterophyllus Lam.): indicators of diversity, selection and germplasm dispersion in Uganda. Scientific African, 22, Article e01900. https://doi.org/10.1016/j.sciaf.2023.e01900
Nantongo, J. S., Mudondo, S., Oluk, R., Agaba, H., & Gwali, S. (2022). Variation in seed and seedling traits of the different ethno-varieties of jackfruit, a potential fruit tree species for food security. Trees, Forests and People, 9, Article 100303. https://doi.org/10.1016/j.tfp.2022.100303
National Plant Germplasm System. (2023). Taxon: Artocarpus heterophyllus Lam. https://npgsweb.ars-grin.gov/gringlobal/taxon/taxonomydetail?id=70095
Natta, S., Pal, K., Alam, B. K., Mondal, D., Dutta, S. K., Sahana, N., Mandal, S., Bhowmick, N., Das, S. S., Mondal, P., Pandit, G. K., Paul, P. K., & Choudhury, A. (2023). In-depth evaluation of nutritive, chemical constituents and anti-glycemic properties of jackfruit (Artocarpus heterophyllus Lam) clonal accessions with flake colour diversity from Eastern Sub-Himalayan plains of India. Food Chemistry, 407, Article 135098. https://doi.org/10.1016/j.foodchem.2022.135098
Nidhina, K., Abraham, B., Fontes-Candia, C., Martínez-Abad, A., Martínez-Sanz, M., Nisha, P., & López-Rubio, A. (2022). Physicochemical and functional properties of pectin extracted from the edible portions of jackfruit at different stages of maturity. Journal of the Science of Food and Agriculture, 103(6), 3194–3204. https://doi.org/10.1002/jsfa.12391
Odukwe, C. N., Onunkwo, D. N., Eburuaja, A. S., & Mathias, V. N. (2017). Carcass and internal organ characteristics of broiler chickens fed soybean diets partially replaced with variable levels of raw jackfruit seed meal. Nigeria Agricultural Journal, 48(1), 190–198. https://www.ajol.info/index.php/naj/article/view/162708
Ortega-González, L., Güemes-Vera, N., Piloni-Martini, J., Quintero-Lira, A., & Soto-Simental, S. (2022). Substitution of wheat flour by jackfruit (Artocarpus heterophyllus lam.) seed flour: effects on dough rheology and deep-frying doughnuts texture and sensory analysis. International Journal of Gastronomy and Food Science, 30, Article 100612. https://doi.org/10.1016/j.ijgfs.2022.100612
Page, M. J., McKenzie, J. E., Bossuyt, P. M., Boutron, I., Hoffmann, T. C., Mulrow, C. D., Shamseer, L., Tetzlaff, J. M., Akl, E. A., Brennan, S. E., Chou, R., Glanville, J., Grimshaw, J. M., Hróbjartsson, A., Lalu, M. M., Li, T., Loder, E. W., Mayo-Wilson, E., McDonald, S., … Moher, D. (2021). Declaración PRISMA 2020: una guía actualizada para la publicación de revisiones sistemáticas. Revista Española de Cardiología, 74(9), 790–799. https://doi.org/10.1016/j.recesp.2021.06.016
Papa Spada, F., Da Silva, P. P. M., Mandro, G. F., Margiotta, G. B., Spoto, M. H. F., & Canniatti-Brazaca, S. G. (2018). Physicochemical characteristics and high sensory acceptability in cappuccinos made with jackfruit seeds replacing cocoa powder. PLoS ONE, 13(8), Article e0197654. https://doi.org/10.1371/journal.pone.0197654
Ramli, A. N. M., Hamid, H. A., Zulkifli, F. H., Zamri, N., Bhuyar, P., & Manas, N. H. A. (2021). Physicochemical properties and tenderness analysis of bovine meat using proteolytic enzymes extracted from pineapple (Ananas comosus) and jackfruit (Artocarpus heterophyllus) by-products. Journal of Food Processing and Preservation, 45(11), Article e15939. https://doi.org/10.1111/jfpp.15939
Ramos-Martínez, O., González-Cruz, E. M., Calderón-Santoyo, M., & Ragazzo-Sánchez, J. A. (2022). Polyisoprenes obtained from jackfruit latex (Artocarpus heterophyllus L.): extraction and characterization. Journal of Applied Polymer Science, 139(25), Article e52392. https://doi.org/10.1002/app.52392
Ranasinghe, R. A. S. N., Maduwanthi, S. D. T., & Marapana, R. A. U. J. (2019). Nutritional and health benefits of jackfruit (Artocarpus heterophyllus lam.): A review. International Journal of Food Science, 2019(1), Article 4327183. https://doi.org/10.1155/2019/4327183
Rubiyah, M. H., Melethil, K., Varghese, S., Kurian, M., Babu, S., Jojo, L., & Thomas, B. (2023). Isolation and characterization of cellulose nanofibrils from agro-biomass of Jackfruit (Artocarpus heterophyllus) rind, using a soft and benign acid hydrolysis. Carbohydrate Polymer Technologies and Applications, 6, Article 100374. https://doi.org/10.1016/j.carpta.2023.100374
Sabidi, S., Koh, S. P., Abd Shukor, S., Adzni Sharifudin, S., & Sew, Y. S. (2020). Safety assessment of fermented jackfruit (Artocarpus heterophyllus) pulp and leaves in Sprague-Dawley rats. Food Science & Nutrition, 8(8), 4370–4378. https://doi.org/10.1002/fsn3.1734
Samrot, A. V., & Sean, T. C. (2022). Investigating the antioxidant and antimicrobial activity of Artocarpus heterophyllus Lam. (Jackfruit) Latex. Biointerface Research in Applied Chemistry, 12(3), 3019–3033. http://dpi.org/10.33263/BRIACI23.30193033
Servicio de Información Agroalimentaria y Pesquera. (2022). Anuario estadístico de la producción agrícola. https://nube.siap.gob.mx/cierreagricola/
Spada, F. P., De Alencar, S. M., & Purgatto, E. (2022). Comprehensive chocolate aroma characterization in beverages containing jackfruit seed flours and cocoa powder. Future Foods, 6, Article 100158. https://doi.org/10.1016/j.fufo.2022.100158
Sulaiman, M. A., Yusoff, F. M., Kamarudin, M. S., Amin, S. M. N., & Kawata, Y. (2022). Fruit wastes improved the growth and health of hybrid red tilapia Oreochromis sp. and Malaysian mahseer, Tor tambroides (Bleeker, 1854). Aquaculture Reports, 24, Article 101177. https://doi.org/10.1016/j.aqrep.2022.101177
Sy Mohamad, S. F., Mohd Said, F., Abdul Munaim, M. S., Mohamad, S., & Wan Sulaiman, W. M. A. (2019). Proximate composition, minerals contents, functional properties of Mastura variety jackfruit (Artocarpus heterophyllus) seeds and lethal effects of its crude extract on zebrafish (Danio rerio) embryos. Food Research, 3(5), 546–555. https://doi.org/10.26656/fr.2017.3(5).095
Thanh, L. P., Kha, P. T. T., Tinh, P. V. T., & Hang, T. T. T. (2021). Effect of jackfruit leaves on feed utilization and ruminal fermentation of growing goats. Livestock Research for Rural Development, 33(8), Article 104. https://www.lrrd.org/lrrd33/8/33104phuoc.html
Ulloa, J. A., Villalobos Barbosa, M. C., Resendiz Vazquez, J. A., Rosas Ulloa, P., Ramírez Ramírez, J. C., Silva Carrillo, Y., & González Torres, L. (2017). Production, physico-chemical and functional characterization of a protein isolate from jackfruit (Artocarpus heterophyllus) seeds. CYTA - Journal of Food, 15(4), 497–507. https://doi.org/10.1080/19476337.2017.1301554
Utari, A., & Warly, L. (2021). Tannin contents of jackfruit leaves (Artocarpus heterophyllus) extract and moringa leaves (Moringa oleifera) extract as functional additive feed in ruminan livestock. IOP Conference Series: Earth and Environmental Science, 757, Article 012054. http://doi.org/10.1088/1755-1315/757/1/012054
Wignyanto, W., Rahmah, N. L., & Margani, A. D. (2014). The best solvent and extraction time in pectin production made from waste of jackfruit (bark and straw). Agroindustrial Journal, 3(1), 141–148. https://doi.org/10.22146/aij.v3i1.25030
Wirayudha, P., Setyono, W., Budisatria, I. G. S., Rahmawati, R., & Kustantinah, K. (2022). Effects of dietary supplementation with jackfruit leaves and soybean meal on nutrient intake and digestibility in sheep. Proceedings of the 6th International Seminar of Animal Nutrition and Feed Science, 21, 82–85. http://doi.org/10.2991/absr.k.220401.018
Wu, J., Zhou, X., Zhou, L., Liu, W., Zhong, J., Zhang, Y., & Liu, C. (2022). Physicochemical, structural, and functional properties of protein fractions and protein isolate from jackfruit seeds. Journal of Food Science, 87(4), 1540–1551. https://doi.org/10.1111/1750-3841.16104
Xu, F., He S. Z., Chu, Z., Zhang Y. J., & Tan, L. H. (2015). Effects of heat treatment on polyphenol oxidase activity and textural properties of jackfruit bulb. Journal of Food Processing and Preservation, 40(5), 943–949. https://doi.org/10.1111/jfpp.12673
Zeng, S., Cao, J., Wei, C., Chen, Y., Liu, Q., Li, C., Zhang, Y., Zhu., K., Wu, G., & Tan, L. (2023). Polysaccharides from Artocarpus heterophyllus Lam. (jackfruit) pulp alleviate obesity by modulating gut microbiota in high fat diet-induced rats. Food Hydrocolloids, 139, Article 108521. https://doi.org/10.1016/j.foodhyd.2023.108521
Zhang, L., Tu, Z.-C., Xie, X., Wang, H., Wang, H., Wang, Z.-X., Sha, X.-M., & Lu, Y. (2017). Jackfruit (Artocarpus heterophyllus Lam.) peel: a better source of antioxidants and α-glucosidase inhibitors than pulp, flake and seed, and phytochemical profile by HPLC-QTOF-MS/MS. Food Chemistry, 234, 303–313. https://doi.org/10.1016/j.foodchem.2017.05.003
Zhang, Z., Wang, Y., Zhang, Y., Chen, K., Chang, H., Ma, C., Jiang, S., Huo, D., Liu, W., Jha, R., & Zhang, J. (2021). Synergistic effects of the jackfruit seed sourced resistant starch and Bifidobacterium pseudolongum subsp. globosum on suppression of hyperlipidemia in mice. Foods, 10(6), Article 1431. https://doi.org/10.3390/foods10061431
Zuwariah, I., Noor Fadilah, M. B., Hadijah, H., & Rodhiah, R. (2018). Comparison of amino acid and chemical composition of jackfruit seed flour treatment. Food Research, 2(6), 539–545. https://doi.org/10.26656/fr.2017.2(6).106

Esta obra está bajo una licencia de Creative Commons Reconocimiento-NoComercial-SinObraDerivada 4.0 Internacional.
Puede hallar permisos más allá de los concedidos con esta licencia en pccmca@gmail.com