Agronomía Mesoamericana
Artículo científico
Volumen 36: Artículo 63141, 2025
e-ISSN 2215-3608, https://doi.org/10.15517/am.2025.63141
https://revistas.ucr.ac.cr/index.php/agromeso/index
Variaciones en la estructura subpoblacional cinemática del semen criopreservado de ganado lechero*
Kinematic subpopulation structure variations in cryopreserved semen from dairy cattle
Juan M. Solís1, Francisco Sevilla1,2, Ignacio Araya-Zúñiga3, Kenneth Matamoros1, Laura Murillo1, Patricia Cervantes4, Antonio Hernández4, Anthony Valverde1
* Recepción: 14 de enero, 2025. Aceptación: 26 de febrero, 2025. Este trabajo formó parte del proyecto de investigación VIE-5402-2151-1016 “Protaminas: evolución y papel en la protección del ADN espermático, formación de la cabeza y funcionamiento celular (PROTASPERM)”, inscrito en la Vicerrectoría de Investigación y Extensión (VIE) del Instituto Tecnológico de Costa Rica.
1 Instituto Tecnológico de Costa Rica, Escuela de Agronomía, Centro de Investigación y Desarrollo en Agricultura Sostenible del Trópico Húmedo, Laboratorio de Reproducción Animal, Campus Tecnológico Local San Carlos. Alajuela, Costa Rica. solissalazarjuanmanuel@gmail.com (https://orcid.org/0009-0005-8293-3748); kenneth.matamoros@estudiantec.cr (https://orcid.org/0000-0002-0827-9726); lalamurillos8@gmail.com (https://orcid.org/0000-0002-8628-4651); anvalverde@tec.ac.cr (autor para correspondencia, https://orcid.org/0000-0002-3191-6965).
2 Instituto Tecnológico de Costa Rica, Universidad Nacional, Universidad Estatal a Distancia, Doctorado en Ciencias Naturales para el Desarrollo (DOCINADE). Alajuela, Costa Rica. f.sevilla@tec.ac.cr (https://orcid.org/0000-0003-1480-4141).
3 Instituto Tecnológico de Costa Rica, Área Académica del Doctorado en Ciencias Naturales para el Desarrollo (DOCINADE). Maestría en Ciencia y Tecnología para la Sostenibilidad. Alajuela, Costa Rica. igaraya@estudiantec.cr (https://orcid.org/0000-0002-4292-2287).
4 Universidad Veracruzana, Facultad de Medicina Veterinaria y Zootecnia, Maestría en Ciencia Animal, Biología de la Reproducción Animal, Cuerpo Académico Biotecnología y Reproducción. Veracruz 91710, México. pcervantes@uv.mx (https://orcid.org/0000-0002-6695-4793); anhernandez@uv.mx (https://orcid.org/0000-0001-9719-6537).
Resumen
Introducción. En la industria lechera, el semen congelado-descongelado es importante para la inseminación artificial y la mejora genética del ganado. Objetivo. Evaluar la variación en la estructura subpoblacional cinemática del semen congelado-descongelado en razas Jersey y Holstein usando un sistema CASA-mot. Materiales y métodos. El estudio se realizó de abril a noviembre de 2023, en el Laboratorio de Reproducción Animal (AndroTEC), ubicado en el Campus Tecnológico Local San Carlos, Alajuela, Costa Rica. Se utilizaron ocho animales de las razas Holstein y Jersey, y se analizaron nueve dosis de semen congelado-descongelado por animal para cada raza. Se descongelaron a 37 °C durante 30 s, 72 dosis de semen provenientes de ocho toros (cuatro de cada raza) a 37 °C durante 30 s. La movilidad y las variables cinemáticas se analizaron utilizando la tecnología CASA-mot (Computer-Assisted Semen Analysis). Resultados. La raza Jersey presentó mostró mayores porcentajes de espermatozoides móviles totales, móviles progresivos y rápidos en comparación con la raza Holstein (P < 0,05). El análisis de factores principales reveló dos factores significativos que explicaron el 87,5 % de la varianza total en las variables cinemáticas. Las variables cinemáticas entre subpoblaciones espermáticas (SP) presentaron diferencias (P < 0,05) en ambas razas. La subpoblación SP2 fue la más veloz, con valores más altos en velocidad curvilínea (VCL), velocidad rectilínea (VSL) y velocidad de trayectoria promedio (VAP) tanto para los toros Holstein como los Jersey. Conclusiones. Se encontraron diferencias cinemáticas entre las subpoblaciones identificadas para en ambas razas. Los patrones cinemáticos de las subpoblaciones presentes en el eyaculado podrían influir en la fertilidad y rendimiento reproductivo.
Palabras clave: ciencia animal, calidad del semen, espermatozoide, toros, movilidad espermática, inseminación artificial.
Abstract
Introduction. In the dairy industry, frozen-thawed semen is crucial for artificial insemination and genetic improvement of cattle. Objective. To evaluate the variation in the kinematic subpopulation structure of frozen-thawed semen in Jersey and Holstein breeds using a CASA-mot system. Materials and Methods. The study was conducted from April to November 2023, at the Animal Reproduction Laboratory (AndroTEC), located at the Campus Tecnológico Local San Carlos, Alajuela, Costa Rica. Eight animals from the Holstein and Jersey breeds were used, and nine doses of frozen-thawed semen per animal were analyzed for each breed. A total of 72 semen doses from eight bulls (four from each breed) were thawed at 37 °C for 30 s. Sperm motility and kinematic variables were analyzed using CASA-mot (Computer-Assisted Semen Analysis) technology. Results. The Jersey breed presented higher percentages of total motile, progressive motile, and rapid spermatozoa compared to the Holstein breed (P < 0.05). Principal component analysis revealed two significant factors explaining 87.5 % of the total variance in kinematic variables. The kinematic variables between sperm subpopulations (SP) showed differences (P < 0.05) in both breeds. Subpopulation SP2 was the fastest, with higher values for curvilinear speed (VCL), straight-line speed (VSL), and average trajectory speed (VAP) in both Holstein and Jersey bulls. Conclusions. Kinematic differences were found between the identified subpopulations in both breeds. The kinematic patterns of the subpopulations present in the ejaculate could influence fertility and reproductive performance.
Keywords: animal science, semen quality, spermatozoa, bulls, sperm motility, artificial insemination.
Introducción
En la industria lechera, el semen congelado-descongelado se utiliza principalmente en inseminación artificial (IA) (Chicaiza-Cabezas et al., 2023), lo que favorece la mejora genética del ganado lechero (Koch et al., 2022). La variabilidad en la calidad del semen congelado-descongelado tiene una base genética (Selvaraju et al., 2018). Sin embargo, también existen factores moleculares, como la presencia de proteínas específicas asociadas con la criotolerancia, que podrían influir en la capacidad de congelación del semen (Gomes et al., 2020). Además, los factores ambientales, entre ellos la temperatura y el tiempo de descongelación, pueden afectar la eficiencia del proceso y la calidad del semen después de la descongelación (Yánez-Ortiz et al., 2022).
La fertilidad de los toros utilizados en inseminación artificial debe considerar la calidad inicial de los eyaculados mediante la determinación de las características óptimas en los espermatozoides (Yániz et al., 2015). Los eyaculados se pueden considerar como conjuntos heterogéneos que se distribuyen mediante subpoblaciones espermáticas y que pueden explicar los cambios en la fertilidad de los machos (Martínez-Pastor, 2022; Valverde, Castro-Morales, et al., 2019). Esto remarca la idea de que hay variación individual entre machos respecto de la fertilidad (Valverde et al., 2016) y es necesario evaluar con mayor exactitud y precisión la calidad seminal de los reproductores.
Se ha demostrado que la validación de protocolos óptimos de descongelación del semen criopreservado (Solís et al., 2024) puede mejorar los parámetros de movilidad de los espermatozoides y la preservación de la integridad celular (Layek et al., 2016). Estos protocolos deben incluir la valoración de la calidad espermática mediante métodos objetivos de análisis (Gallagher et al., 2018; Mortimer & De Jonge, 2018; Soler, Valverde, et al., 2017; Yániz, Silvestre, et al., 2018), lo cual se logra mediante la evaluación in vitro de la movilidad espermática con sistemas computacionales de análisis espermático (Computer-Assisted Semen Analysis, CASA) (Bompart et al., 2019; Gacem et al., 2020).
La caracterización de los eyaculados mediante subpoblaciones espermáticas en función de variables cinemáticas es posible debido a la tecnología CASA. Esto ha posibilitado caracterizar subpoblaciones espermáticas en diversas especies como bovinos de leche (Valverde et al., 2016), bovinos de carne (Araya-Zúñiga et al., 2024), ovinos (Barbas et al., 2018), caprinos (Vázquez et al., 2015), verracos (Valverde, Madrigal, et al., 2019), caballos (Gacem et al., 2021), burros (Gacem et al., 2020), conejos (Quintero-Moreno et al., 2007) y llamas (Cucho et al., 2021). La información que se obtiene de estos análisis permite describir funcionalmente los gametos masculinos y considera la variación intrínseca de los eyaculados (Barquero, Roldan, et al., 2021; Barquero, Soler, et al., 2021; Holt & Satake, 2018). También se han realizado análisis de subpoblaciones espermáticas en otras especies de animales como perros (Soler, Alambiaga, et al., 2017; Valverde, Arnau, et al., 2019), zorros (Soler, Contell, et al., 2017), venados (Cucho et al., 2022), salmones (Caldeira et al., 2018; 2019), cocodrilos (Valverde et al., 2021), caimanes (Valverde, Madrigal-Valverde, et al., 2019), aves (García-Herreros, 2016) y humanos (García-Molina et al., 2022; 2023).
El análisis de subpoblaciones espermáticas ha permitido comprender mejor el funcionamiento del eyaculado en las especies y explicar el fenómeno de la fertilidad (Valverde et al., 2021). Desde un punto de vista biológico, la distribución de subpoblaciones en el eyaculado ha servido de base para plantear la hipótesis del mecanismo de selección espermática que ha favorecido el éxito de las especies con el paso de los años (Martínez-Pastor, 2022).
La evaluación de la temperatura y el tiempo de descongelación del semen puede proporcionar información adicional para evaluar los efectos del proceso mediante pruebas de resistencia térmica (TRT) (Solís et al., 2024). La TRT busca simular las condiciones del tracto reproductivo femenino (Schulze et al., 2019). Las muestras de esperma son heterogéneas (Valverde et al., 2016), lo que implica que en un mismo eyaculado coexisten espermatozoides con diferentes patrones cinemáticos y de movilidad (García-Molina et al., 2020; Valverde, Castro-Morales, et al., 2019; Víquez et al., 2021).
Actualmente, el eyaculado se puede considerar como un conglomerado de subpoblaciones de espermatozoides bien definido, cuyo significado biológico se está entendiendo mejor en diversas especies (Barquero, Roldan, et al., 2021; Víquez et al., 2020). Esto ha conllevado a mejorar la caracterización de las subpoblaciones para explicar con mayor precisión la fertilidad potencial de un eyaculado (Ibanescu et al., 2020). Por lo tanto, el objetivo del presente estudio fue evaluar la variación en la estructura subpoblacional cinemática del semen congelado-descongelado en razas Jersey y Holstein usando un sistema CASA-mot.
Materiales y métodos
Aprobación ética
Este estudio fue aprobado de conformidad con los principios éticos, por el Comité del Centro de Investigación y Desarrollo en Agricultura Sostenible para el Trópico Húmedo del Instituto Tecnológico de Costa Rica (CIDASTH-ITCR), según la Sección 08/2023, artículo 5.0, DAGSC-075-2023 y CIE-206-2023.
Período de estudio y ubicación
La investigación se realizó de abril a noviembre de 2023 en el Laboratorio de Reproducción Animal (AndroTEC), ubicado en el Campus Tecnológico Local San Carlos del Instituto Tecnológico de Costa Rica, en Santa Clara, Florencia, San Carlos, Alajuela, Costa Rica (CRTM05; X: 444296 Y: 1146016). El sitio se encuentra a una altitud de 70 m s. n. m., y en condiciones climatológicas de trópico húmedo.
Dosis de semen, procedimientos de descongelación y diseño del estudio
En este trabajo se utilizaron 72 dosis de semen congelado-descongelado provenientes de ocho toros de dos razas (Holstein, n = 4; Jersey, n = 4). Para los análisis, se emplearon nueve dosis de semen por toro, envasadas en pajillas de 0,25 mL de volumen y almacenadas en un tanque criogénico MVE® XC 20 Signature (MVE Biological Solutions, Ball Ground, Georgia, EE. UU.). Cada dosis se descongeló en un baño de agua de laboratorio termorregulado (Digisystem Laboratory Instruments Inc., New Taipei City, Taiwán) a 37 °C durante 30 s. Después de la descongelación, el contenido de cada pajilla se diluyó 1:10 (vol:vol) con el diluyente comercial OptiXcell® (IMV, L’Aigle, Francia) en tubos Eppendorf® (Sigma-Aldrich, St. Louis, Misuri, EE. UU.).
Evaluación del semen
El análisis se realizó mediante el sistema CASA-mot ISAS®v1 (Sistema Integrado de Análisis de Semen, Proiser I+D, Paterna, España), equipado con una cámara de video (Proiser 782M, Proiser I+D) que capturaba imágenes a 50 fotogramas por segundo (fps) y una resolución final de 768 × 576 píxeles. La cámara se conectó a un microscopio UB203 (UOP/Proiser R+D) con un ocular de 1× y un objetivo de contraste de fase negativa de 10× (AN 0,25). El microscopio contaba con una platina térmica integrada, fijada a 37,0 ± 0,5 °C. Se colocaron submuestras de 3 µL de semen descongelado en una cámara de recuento Spermtrack® (Proiser I+D, Paterna, España) precalentada a 37 °C. Para cada muestra evaluada se realizaron dos réplicas. Se capturaron al menos siete campos microscópicos, con un total mínimo de 600 espermatozoides, registrando su movilidad y cinética. Para los análisis, se utilizaron los porcentajes de movilidad total (TM) y movilidad progresiva (PM), junto con velocidad rectilínea (VSL, μm s-1), velocidad curvilínea (VCL, μm s-1), velocidad de trayectoria promedio (VAP, μm s-1), frecuencia de cruce (BCF, Hz), desplazamiento lateral de la cabeza (ALH, μm), linealidad (LIN=VSL/VCL·100), rectitud (STR=VSL/VAP·100) y oscilación (WOB=VAP/VCL·100).
Análisis estadístico
Los supuestos de normalidad y homocedasticidad se evaluaron mediante las pruebas de Shapiro-Wilk y Levene. Además, la normalidad de los parámetros espermáticos se estimó mediante la prueba probabilística normal. Una vez probadas las hipótesis de distribución normal y homogeneidad de varianzas, se ejecutó un análisis de variancia (ANDEVA) de medias repetidas. El efecto de la raza sobre las características cinemáticas del esperma bovino se analizó mediante ANDEVA de medidas repetidas. Se utilizaron modelos generales lineales y mixtos para evaluar las variables cinemáticas y de movilidad del esperma bovino. Se efectuaron pruebas de comparación múltiple mediante el método de mínimos cuadrados, con una corrección de Bonferroni y un nivel de significación estadística de P < 0,05.
Se creó un subconjunto de datos a partir de las ocho variables cinemáticas y se realizaron procedimientos multivariados para identificar grupos a partir de este subconjunto de datos cinemáticos de espermatozoides. Todos los valores de las variables cinemáticas fueron estandarizados para evitar cualquier efecto de escala. Se ejecutó un análisis de factores principales (PFA, por sus siglas en inglés) sobre estos datos para derivar una pequeña cantidad de combinaciones lineales que aún conservaban la mayor cantidad de información posible de las variables originales. Las comunalidades previas para este análisis se estimaron a partir del coeficiente máximo de correlación absoluta entre cada variable y cualquier otra. El número de factores principales (FP) a extraer se determinó a partir del criterio de Kaiser, es decir, se seleccionaron solo aquellos con un valor propio >1. También se obtuvo la estadística KMO (Kaiser, Meyer, Olkin) como medida de la adecuación del conjunto de datos para la extracción de factores. Como método de rotación, se utilizó el método Varimax con normalización de Kaiser.
Se exploraron las correlaciones entre factores y variables cinemáticas originales para comprender mejor el significado de los factores extraídos. Además, se efectuó un análisis para clasificar los espermatozoides en un número reducido de grupos, según las puntuaciones obtenidas del análisis factorial. Esto se logró en dos fases con la combinación de procedimientos de agrupamiento jerárquico y no jerárquico. En primer lugar, las puntuaciones de los factores para todos los eyaculados se agruparon jerárquicamente utilizando el método de varianza mínima de Ward. En segundo lugar, el número óptimo de conglomerados obtenido en el análisis anterior se utilizó como número objetivo de conglomerados en un análisis de conglomerados de K-medias no jerárquico.
Se aplicó un ANDEVA para evaluar las diferencias estadísticas entre grupos para todas las variables cinemáticas. El umbral de significación se definió como P < 0,05. También se llevó a cabo una comparación por pares entre las medias de los grupos mediante la prueba de Tukey-Kramer. Los resultados se presentaron como media ± desviación estándar de la media. Todos los datos se analizaron utilizando el programa estadístico IBM SPSS, versión 23.0, para Windows (SPSS Inc., Chicago, Illinois, EE. UU.).
Resultados
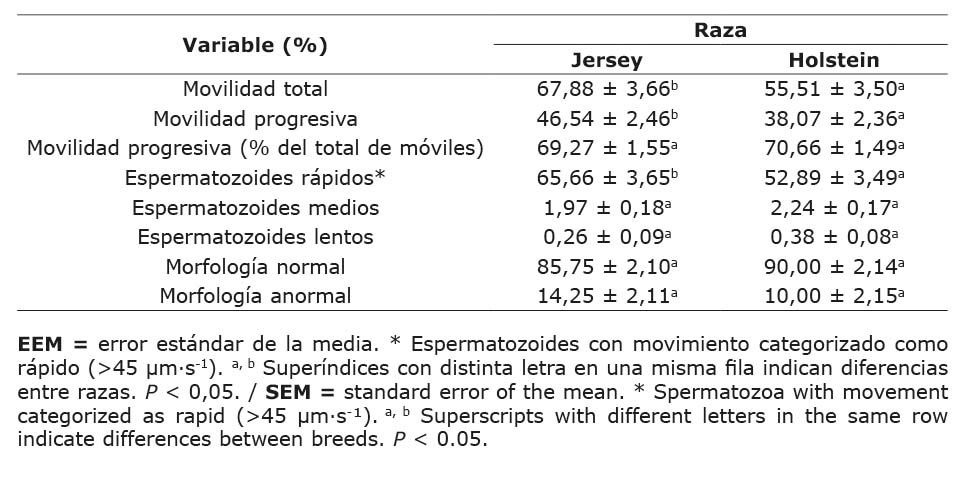
Los toros Jersey presentaron valores mayores de espermatozoides móviles totales, móviles progresivos y espermatozoides con movimiento categorizado como rápido que los toros Holstein (P < 0,05; Cuadro 1). Los porcentajes de las variables de movilidad espermática categorizadas con movimiento medio y lento no fueron significativamente diferentes entre las dos razas. No hubo diferencias entre los porcentajes de morfoanomalías espermáticas entre razas.
Cuadro 1. Variables de movilidad espermática (media ± EEM) en dosis seminales congeladas-descongeladas de ganado lechero. Instituto Tecnológico de Costa Rica (ITCR), Laboratorio de Reproducción Animal, Costa Rica, 2023.
Table 1. Sperm motility variables (mean ± SEM) in frozen-thawed semen doses from dairy cattle. Instituto Tecnológico de Costa Rica (ITCR), Laboratorio de Reproducción Animal, Costa Rica, 2023.
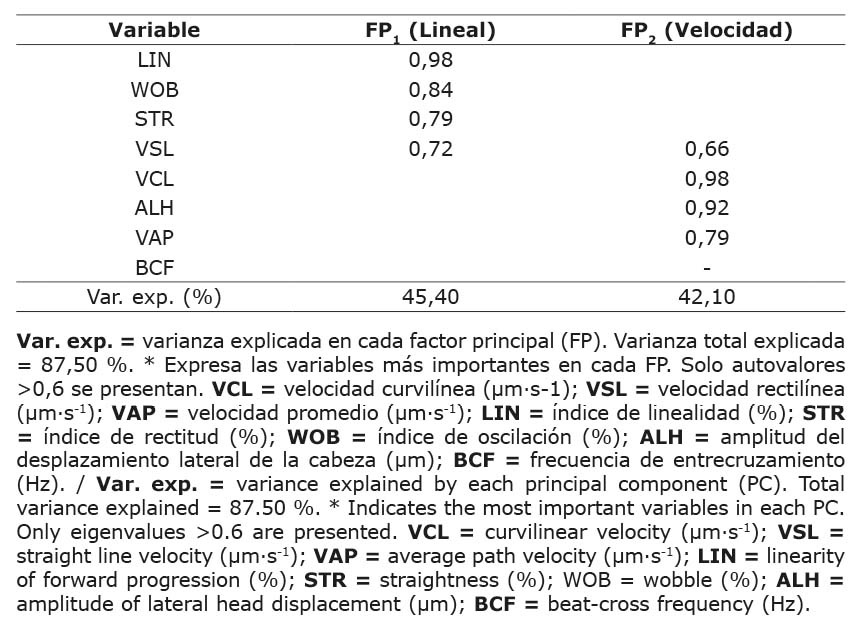
El análisis de factores principales indicó un valor estadístico KMO (Kaiser, Meyer, Olkin) de 0,61, y las estimaciones finales de comunalidad estuvieron por encima de 0,90 para todas las variables cinemáticas, excepto BCF (0,05). Según el criterio de Kaiser, de estos datos se extrajeron dos FP significativos que representaron el 87,50 % de la varianza total. El primer FP, definido como trayectoria lineal (FP1), fue responsable del 45,40 % de la varianza y se asoció principalmente con las variables cinemáticas LIN, WOB, STR y VSL, con la mayor correlación para LIN (0,985). El segundo FP, definido como velocidad (FP2), estuvo fuertemente asociado con las variables VCL, ALH, VAP y VSL, con la mayor correlación para VCL (0,983) (Cuadro 2).
Cuadro 2. Valores propios (correlaciones) entre variables de cinética espermática en semen criopreservado de ganado lechero (solución rotada) y factores principales (FP1, FP2)*. Instituto Tecnológico de Costa Rica (ITCR), Laboratorio de Reproducción Animal, Costa Rica, 2023.
Table 2. Eigenvalues (correlations) between sperm kinematic variables in cryopreserved semen from dairy cattle (rotated solution) and principal components (PC1, PC2)*. Instituto Tecnológico de Costa Rica (ITCR), Laboratorio de Reproducción Animal, Costa Rica, 2023.
El semen bovino congelado-descongelado se agrupó en tres grupos de acuerdo con la varianza mínima jerárquica de Ward, seguido de procedimientos de agrupamiento de k-medias no jerárquicos (Cuadro 3). Los parámetros cinemáticos caracterizaron el movimiento de los espermatozoides como subpoblación 2 (SP2), que fueron los espermatozoides con mayor VCL y VSL (229,65 ± 0,57 µm s-1; 104,18 ± 0,41 µm s-1, respectivamente). Estos eyaculados presentan espermatozoides con mayor BCF y ALH (15,70 ± 0,08 Hz; 5,35 ± 0,01 µm, respectivamente).
Cuadro 3. Variables cinemáticas (media ± EEM) de tres subpoblaciones (SPs) espermáticas en dosis seminales congeladas-descongeladas de ganado lechero. Instituto Tecnológico de Costa Rica (ITCR), Laboratorio de Reproducción Animal, Costa Rica, 2023.
Table 3. Kinematic variables (mean ± SEM) of three sperm subpopulations (SP) in frozen-thawed semen doses from dairy cattle. Instituto Tecnológico de Costa Rica (ITCR), Laboratorio de Reproducción Animal, Costa Rica, 2023.
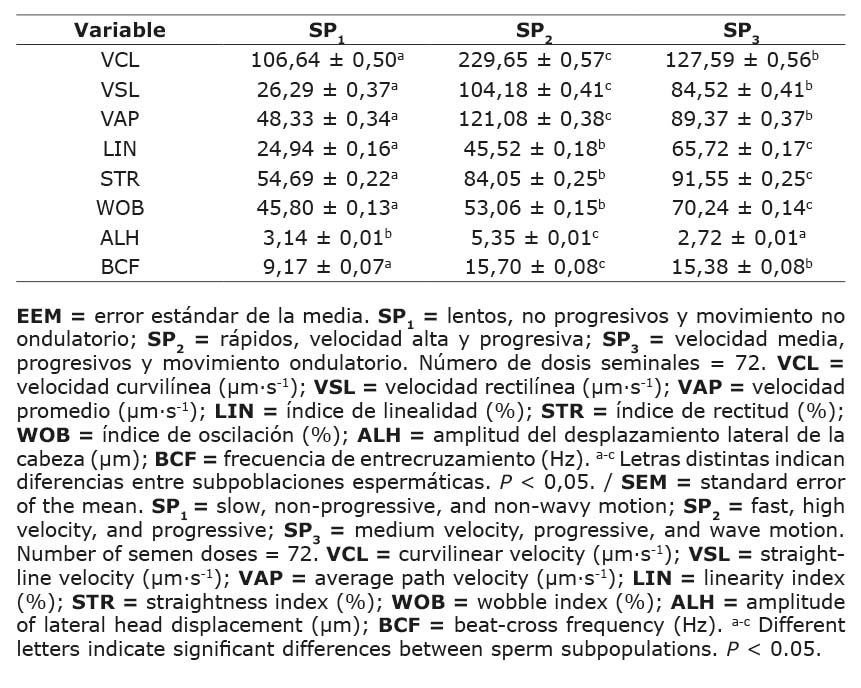
La subpoblación 3 (SP3) incluyó espermatozoides caracterizados por VSL alto (84,52 ± 0,41 µm s-1) y los valores más altos de LIN y STR (65,72 ± 0,17 %; 91,55 ± 0,25 %, respectivamente). La subpoblación 1 (SP1) presentó espermatozoides menos lineales, como lo indican los menores VSL y VAP (26,29 ± 0,37 µm s-1; 48,33 ± 0,34 µm s-1, respectivamente). Los espermatozoides de esta subpoblación también mostraron la menor progresividad, con los valores más bajos de LIN y STR (24,94 ± 0,16 %; 54,69 ± 0,22 %, respectivamente) (Cuadro 3).
Se hallaron diferencias (P < 0,05) entre las subpoblaciones espermáticas (SP1, SP2 y SP3) para las razas Jersey y Holstein. En la raza Jersey, la SP2 presentó los valores más altos en VCL (244,54 ± 0,76 µm-1), mientras que la SP1 tuvo los valores más bajos en esta variable. En la raza Holstein, se observó un patrón similar. El grupo SP2 mostró los valores más altos en VCL (201,00 ± 0,80 µm s-1) (Figura 1).
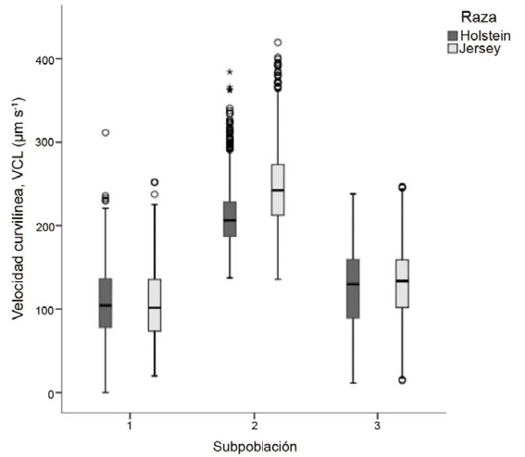
Figura 1. Diagrama de cajas para valores medios de velocidad curvilínea (VCL, µm s-1) en subpoblaciones espermáticas de semen congelado-descongelado de ganado lechero. Instituto Tecnológico de Costa Rica (ITCR), Laboratorio de Reproducción Animal, Costa Rica, 2023.
Figure 1. Box plot of mean curvilinear velocity (VCL, µm s-¹) values in sperm subpopulations of frozen-thawed semen from dairy cattle. Instituto Tecnológico de Costa Rica (ITCR), Laboratorio de Reproducción Animal, Costa Rica, 2023.
Al analizar los índices de linealidad y progresividad celular, se encontró que la SP3 mostró valores más altos (P < 0,05) en LIN (67,52 ± 0,24 %) en la raza Jersey. En la raza Holstein, se halló un patrón similar con valores de LIN (63,07 ± 0,26 %) más altos en la SP3. Los valores más bajos en ambas razas se observaron en la SP1 (Figura 2).
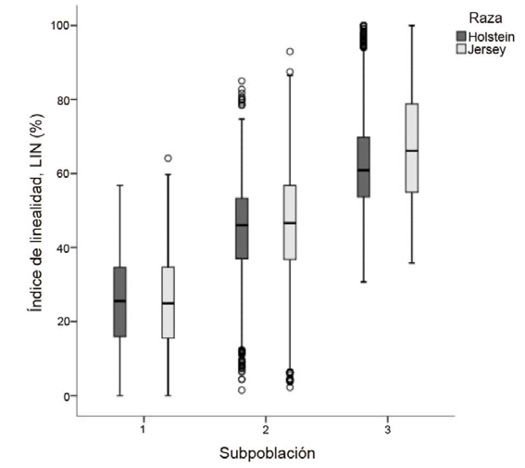
Figura 2. Diagrama de cajas para valores medios de índice de linealidad en subpoblaciones espermáticas de semen congelado-descongelado de ganado lechero. Instituto Tecnológico de Costa Rica (ITCR), Laboratorio de Reproducción Animal, Costa Rica, 2023.
Figure 2. Box plot of mean linearity index values in sperm subpopulations of frozen-thawed semen from dairy cattle. Instituto Tecnológico de Costa Rica (ITCR), Laboratorio de Reproducción Animal, Costa Rica, 2023.
Los valores de ondulación espermática mayores (P < 0,05) en la raza Jersey se presentaron en la SP2, con una frecuencia de entrecruzamiento, BCF (15,93 ± 0,11 Hz), mientras que en la SP1 se encontraron los valores más bajos en esta variable. En la raza Holstein, se observó un patrón similar. La SP2 mostró los valores más altos (P < 0,05) en BCF (15,40 ± 0,12 Hz), mientras que SP1 tuvo los valores más bajos (Figura 3).
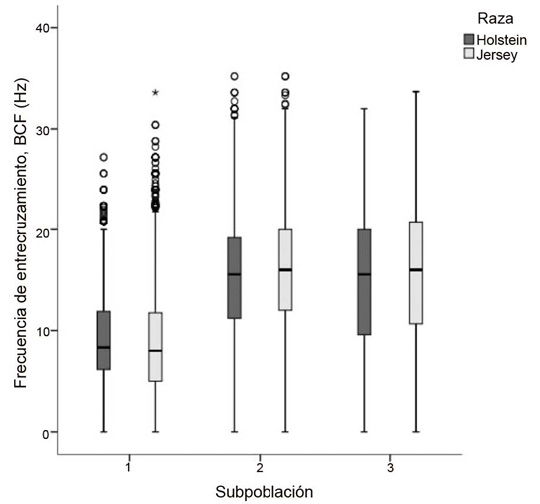
Figura 3. Diagrama de cajas para valores medios de frecuencia de entrecruzamiento en subpoblaciones espermáticas de semen congelado-descongelado de ganado lechero. Instituto Tecnológico de Costa Rica (ITCR), Laboratorio de Reproducción Animal, Costa Rica, 2023.
Figure 3. Box plot of mean beat-cross frequency values in sperm subpopulations of frozen-thawed semen from dairy cattle. Instituto Tecnológico de Costa Rica (ITCR), Laboratorio de Reproducción Animal, Costa Rica, 2023.
Se hallaron diferencias (P < 0,05) entre las subpoblaciones espermáticas (SP1, SP2 y SP3) para las razas Jersey y Holstein. En la raza Jersey, la SP2 presentó los valores más altos en VSL (112,36 ± 0,60 µm s-1) y VAP (130,32 ± 0,53 µm s-1), mientras que la SP1 mostró los valores más bajos en estas mismas variables. En la raza Holstein, se observó un patrón similar. En el grupo SP2 se encontraron los valores más altos en VSL (93,49 ± 0,53 µm s-1) y VAP (109,00 ± 0,51 µm s-1) (Cuadro 4).
Cuadro 4. Variables cinemáticas (media ± EEM) en subpoblaciones espermáticas (SP) de semen criopreservado de ganado lechero. Instituto Tecnológico de Costa Rica (ITCR), Laboratorio de Reproducción Animal, Costa Rica, 2023.
Table 4. Kinematic variables (mean ± SEM) in sperm subpopulations (SP) of cryopreserved semen from dairy cattle. Instituto Tecnológico de Costa Rica (ITCR), Laboratorio de Reproducción Animal, Costa Rica, 2023.
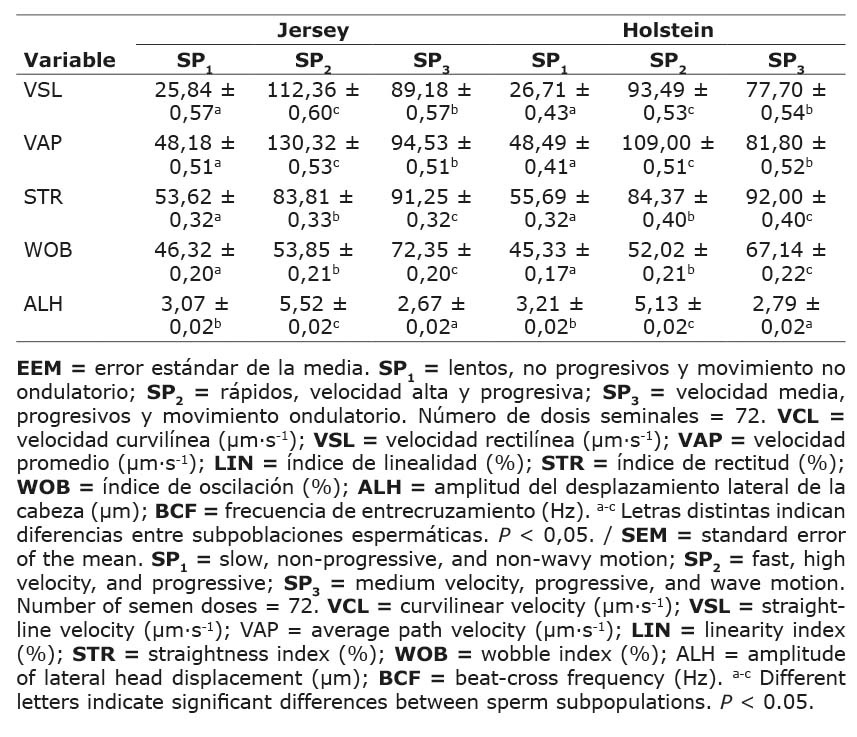
Al analizar los índices de linealidad y progresividad celular se encontró que en la raza Jersey, la SP3 mostró valores más altos (P < 0,05) en STR (91,25 ± 0,32 %) y WOB (72,35 ± 0,20 %). La raza Holstein presentó un patrón similar con valores de STR (92,00 ± 0,40 %) y WOB (67,14 ± 0,22 %) más altos en la SP3. La ALH en la raza Jersey fue mayor (P < 0,05) en la SP2 (5,52 ± 0,02 µm) en comparación con las otras subpoblaciones, mientras que en la raza Holstein se observó un patrón similar. La SP2 exhibió los valores más altos (P < 0,05) en ALH (5,13 ± 0,02 µm) respecto a las demás subpoblaciones (Cuadro 4).
Las trayectorias promedio para las variables de velocidad de cada subpoblación y cada raza se observan en la Figura 4. En general, los patrones de velocidad de las células espermáticas por subpoblación y raza son similares para los grupos SP1 y SP2. En el caso de la SP3, difiere debido a que trayectoria de la raza Holstein muestra una tendencia a ser un movimiento más lineal respecto a la presentada por la raza Jersey.
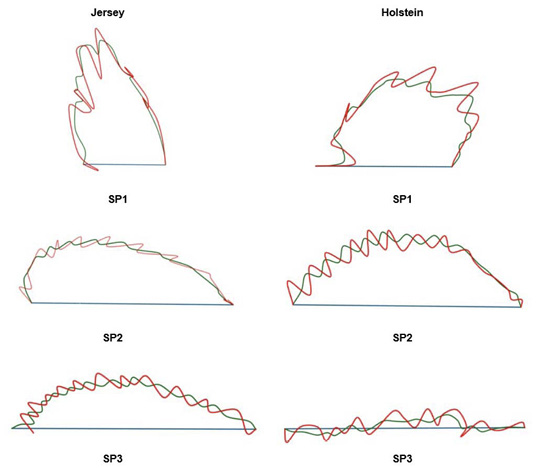
Figura 4. Patrones de natación exhibidos por cada subpoblación espermática de semen congelado-descongelado de ganado lechero. Instituto Tecnológico de Costa Rica (ITCR), Laboratorio de Reproducción Animal, Costa Rica, 2023.
SP1 = subpoblación 1; SP2 = subpoblación 2; SP3 = subpoblación 3.
Figure 4. Swimming patterns exhibited by each sperm subpopulation of frozen-thawed semen from dairy cattle. Instituto Tecnológico de Costa Rica (ITCR), Laboratorio de Reproducción Animal, Costa Rica, 2023.
SP1 = subpopulation 1; SP2 = subpopulation 2; SP3 = subpopulation 3.
Discusión
Las dosis de semen criopreservado de razas lecheras presentaron variaciones en los patrones de movilidad y cinemáticos de los espermatozoides asociadas con los procesos de descongelación. Esto podría deberse a la variación individual dentro de la misma especie con respecto a la calidad seminal posdescongelación (Morrell et al., 2018) y los protocolos de congelación y descongelación utilizados (Botta et al., 2019). Los resultados obtenidos difieren de lo descrito en otros trabajos, donde se evaluó la movilidad progresiva en razas lecheras y se reportaron valores mayores en la raza Holstein (Hoflack et al., 2006).
Algunos estudios han asociado las tasas de preñez en bovino con las subpoblaciones espermáticas de grupos de animales previamente definidos como de alta y baja fertilidad (Hidalgo et al., 2021). Toros de alta fertilidad han mostrado mayor porcentaje de espermatozoides con movilidad total y progresiva elevada porque presentan células con velocidad rápida. En investigaciones previas con ganado lechero se han registrado valores altos de movilidad, progresividad, velocidad rápida y mayor amplitud del desplazamiento lateral de la cabeza del espermatozoide (ALH), lo cual se ha correlacionado con una mayor criotolerancia y alta fertilidad (Kathiravan et al., 2011). Las variables cinemáticas de los espermatozoides han demostrado variar según las razas y pueden estar afectadas por factores extrínsecos (Víquez et al., 2020).
La tecnología CASA permite evaluar variables avanzadas de cinética espermática y contabilizar el registro individual de cada célula mediante una tasa de fotogramas (Barquero, Víquez, et al., 2021; Bompart et al., 2018; 2019). Esto posibilita una mayor confiabilidad en las estimaciones de las trayectorias medidas en el sistema (Van der Horst, 2020). Para mayor practicidad, el sistema puede promediar los valores cinemáticos para generar informes, lo cual puede causar pérdida de información relevante bajo la premisa de la uniformidad del eyaculado (Martínez-Pastor et al., 2011; Ramón & Martínez-Pastor, 2018).
En diversas investigaciones en especies animales como porcinos (Valverde, Madrigal, et al., 2019), bovinos (Araya-Zúñiga et al., 2024; Pichardo-Matamoros et al., 2023; Solís et al., 2024), equinos (Gacem et al., 2021), perros (Valverde, Arnau, et al., 2019), camélidos (Cucho et al., 2021), aves (García-Herreros, 2016), peces (Caldeira et al., 2018) y cocodrilos (Valverde et al., 2021) se ha reconocido la heterogeneidad del eyaculado y se ha asociado a variabilidad en la fertilidad de los machos, como en el presente estudio. Este trabajo aplicó el análisis de subpoblaciones espermáticas para cuantificar la calidad seminal posdescongelación en semen criopreservado de ganado lechero, al utilizar toda la información disponible de los sistemas CASA.
La caracterización de las variables cinemáticas se realizó mediante tres conjuntos o subpoblaciones espermáticas con patrones de natación similares en trabajos previos (Hidalgo et al., 2021; Ibanescu et al., 2020; Ibănescu et al., 2018). El estudio demostró que los toros Jersey poseen mejores patrones de espermatozoides móviles y progresivamente móviles que los de Holstein, lo cual indica que los toros Jersey tienen mejores datos de fertilidad potencial. Los resultados de las subpoblaciones espermáticas mostraron que los mejores valores de movilidad se presentaron en la SP2, al igual que en la raza Holstein, aunque la distribución del número de células asociado con cada subpoblación fue diferente.
Varios autores han afirmado que los valores cinemáticos están relacionados con datos de la tasa de preñez y el índice de fertilidad (Winters et al., 2018). La subpoblación espermática predominante fue la SP2, compuesta por espermatozoides con cinética rápida y ondulatoria. Esta subpoblación muestra características distintivas de espermatozoides hiperactivados y valores intermedios de progresividad, superados solamente por los valores de linealidad e índice de rectitud en la SP3. La cinética de las células hiperactivadas se caracteriza por un patrón de natación robusto, no lineal, con una gran amplitud y un batido flagelar asimétrico, que permite a los espermatozoides penetrar la zona pelúcida (Kathiravan et al., 2011).
Algunos trabajos han reportado que patrones de hiperactivación del semen se han presentado en toros con mayor fertilidad en inseminación artificial (Gallego et al., 2014; Shojaei et al., 2012). También se ha señalado una correlación positiva entre la proporción de espermatozoides con movimientos rápidos y no lineales y las tasas de no retorno al estro de las vacas (Ibanescu et al., 2020). Investigaciones en otras especies, como equinos (Quintero-Moreno et al., 2003) y ovinos (Yániz et al., 2015), han sugerido que la subpoblación espermática que contiene espermatozoides rápidos y lineales se relaciona con mayores tasas de fertilidad; sin embargo, estos estudios se realizaron con semen fresco y en condiciones experimentales distintas a las del presente trabajo.
Diversas investigaciones han determinado subpoblaciones espermáticas en ganado lechero. No obstante, los algoritmos utilizados para describir estos conjuntos celulares en el eyaculado no siempre tienen relevancia biológica (Víquez et al., 2020). Esto conlleva la necesidad de validar los resultados desde el pragmatismo biológico de su significado, además de emplear el método de agrupamiento estadístico apropiado para determinar las subpoblaciones de espermatozoides en muestras seminales. Estos hallazgos constituyen una herramienta que incorpora el volumen de datos aportado por los sistemas CASA (Valverde et al., 2020) y el análisis multivariado de datos para describir animales con mayor proporción de gametos con patrones de natación en subpoblaciones espermáticas con mayor velocidad y linealidad, para proporcionar información adicional sobre la fertilidad de los machos (Barquero, Roldan, et al., 2021).
En el presente trabajo, se caracterizó el semen congelado-descongelado de toros de razas Holstein y Jersey con base en variables como la velocidad y la progresividad espermática. Esto permitió describir tanto eyaculados rápidos y progresivos como lentos y no progresivos. El estudio describió las dosis congeladas-descongeladas en términos de subpoblaciones espermáticas para la caracterización de la fertilidad de los machos de acuerdo con la calidad seminal. Otras investigaciones también han descrito subpoblaciones de espermatozoides (Valverde et al., 2016; Yániz, Palacín, et al., 2018).
La fertilidad es multifactorial, y el semen solo influye en el resultado final. En cambio, la vaca tiene múltiples factores que influyen. Entre los principales factores que afectan tanto la fertilidad de las hembras como de los machos se encuentran el clima (Stefanska et al., 2024), el estado nutricional (Butler, 2014) y la actividad endocrina (Sitko et al., 2024). Adicionalmente, los factores externos en los procesos de poscongelación, como la temperatura y el tiempo en que se descongelan las células, podrían condicionar las características celulares y limitar su funcionalidad.
Conclusiones
El análisis de factores principales mostró que dos factores explican el 87,50 % de la varianza total en las variables cinemáticas del semen congelado-descongelado y permitió su clasificación en tres subpoblaciones de espermatozoides. Se encontraron diferencias en la distribución y los patrones de natación de las subpoblaciones identificadas en ambas razas lecheras. Estos hallazgos sugieren que, aunque existieron diferencias en la movilidad y cinética espermática entre los toros Jersey y Holstein, ambos grupos presentaron subpoblaciones espermáticas con características distintivas que podrían influir en su fertilidad y rendimiento reproductivo.
Agradecimientos
Los autores agradecen a la Vicerrectoría de Investigación y Extensión (VIE) del Instituto Tecnológico de Costa Rica por financiar el proyecto de investigación VIE-5402-2151-1016, “Protaminas: evolución y papel en la protección del ADN espermático, formación de la cabeza y funcionamiento celular (PROTASPERM)”, del cual formó parte este trabajo. Sevilla y Araya-Zúñiga también agradecen a la Dirección de Posgrados del Instituto Tecnológico de Costa Rica.
Conflicto de intereses
Los autores declaran no tener ningún conflicto de interés.
Referencias
Araya-Zúñiga, I., Sevilla, F., Molina-Montero, R., Roldan, E. R. S., Barrientos-Morales, M., Silvestre, M. A., & Valverde, A. (2024). Kinematic and morphometric assessment of fresh semen, before, during and after mating period in brahman bulls. Animals, 14(1), Article 132. https://doi.org/10.3390/ANI14010132
Barbas, J. P., Leahy, T., Horta, A. E., & García-Herreros, M. (2018). Sperm kinematics and subpopulational responses during the cryopreservation process in caprine ejaculates. Cryobiology, 82, 137–147. https://doi.org/10.1016/J.CRYOBIOL.2018.03.005
Barquero, V., Roldan, E. R. S., Soler, C., Yániz, J. L., Camacho, M., & Valverde, A. (2021). Predictive capacity of boar sperm morphometry and morphometric sub-populations on reproductive success after artificial insemination. Animals, 11(4), Article 920. https://doi.org/10.3390/ANI11040920
Barquero, V., Soler, C., Sevilla, F., Calderón-Calderón, J., & Valverde, A. (2021). A Bayesian analysis of boar spermatozoa kinematics and head morphometrics and their relationship with litter size fertility variables. Reproduction in Domestic Animals, 56(7), 1024–1033. https://doi.org/10.1111/RDA.13946
Barquero, V., Víquez, L., Calderón, J. C., & Valverde, A. (2021). Optimal frame rate to evaluate boar sperm kinematic with a CASA-Mot system. Agronomía Mesoamericana, 32(1), 1–18. https://doi.org/10.15517/am.v32i1.41928
Bompart, D., García-Molina, A., Valverde, A., Caldeira, C., Yániz, J., Núñez de Murga, M., & Soler, C. (2018). CASA-Mot technology: how results are affected by the frame rate and counting chamber. Reproduction, Fertility and Development, 30(6), 810–819. https://doi.org/10.1071/RD17551
Bompart, D., Vázquez, R. F., Gómez, R., Valverde, A., Roldán, E. R. S., García-Molina, A., & Soler, C. (2019). Combined effects of type and depth of counting chamber, and rate of image frame capture, on bull sperm motility and kinematics. Animal Reproduction Science, 209, Article106169. https://doi.org/10.1016/J.ANIREPROSCI.2019.106169
Botta, D., de Arruda, R. P., Watanabe, Y. F., de Carvalho Balieiro, J. C., Romanello, N., do Nascimento Barreto, A., de Andrade Pantoja, M. H., Giro, A., de Carvalho, C. P. T., de Sousa Oliveira, A., & Garcia, A. R. (2019). Influence of post-thawing thermal environment on bovine sperm characteristics and in vitro fertility. Andrologia, 51(6), Article e13266. https://doi.org/10.1111/AND.13266
Butler, S. T. (2014). Nutritional management to optimize fertility of dairy cows in pasture-based systems. Animal, 8(Supp. 1), 15–26. https://doi.org/10.1017/S1751731114000834
Caldeira, C., García-Molina, A., Valverde, A., Bompart, D., Hassane, M., Martin, P., & Soler, C. (2018). Comparison of sperm motility subpopulation structure among wild anadromous and farmed male Atlantic salmon (Salmo salar) parr using a CASA system. Reproduction, Fertility and Development, 30(6), 897–906. https://doi.org/10.1071/RD17466
Caldeira, C., Hernández-Ibáñez, S., Valverde, A., Martin, P., Herranz-Jusdado, J. G., Gallego, V., Asturiano, J. F., Dzyuba, B., Pšenička, M., & Soler, C. (2019). Standardization of sperm motility analysis by using CASA-Mot for Atlantic salmon (Salmo salar), European eel (Anguilla anguilla) and Siberian sturgeon (Acipenser baerii). Aquaculture, 502, 223–231. https://doi.org/10.1016/j.aquaculture.2018.12.001
Chicaiza-Cabezas, N., Garcia-Herreros, M., & Aponte, P. M. (2023). Germplasm cryopreservation in bulls: Effects of gonadal tissue type, cryoprotectant agent, and freezing-thawing rates on sperm quality parameters. Cryobiology, 110, 24–35. https://doi.org/10.1016/J.CRYOBIOL.2023.01.001
Cucho, H., Gallegos, M., Ccoiso, R., Meza, A., Ampuero, E., Ordóñez, C., & Valverde, A. (2021). Morfometría y subpoblaciones de espermatozoides de llama (Lama glama) usando el sistema ISAS® CASA-Morph. Revista de Investigaciones Veterinarias del Perú, 32(1), Artículo e19506. https://doi.org/10.15381/RIVEP.V32I1.19506
Cucho, H., Nina, G., Meza, A., Ccalta, R., Ordóñez, C., & Valverde, A. (2022). Subpoblaciones morfométricas de espermatozoides epididimarios del venado de cola blanca (Odocoileus virginianus peruvianus). Agronomía Mesoamericana, 33(2), Artículo 46938. https://doi.org/10.15517/AM.V33I2.469388
Gacem, S., Catalán, J., Valverde, A., Soler, C., & Miró, J. (2020). Optimization of Casa-mot analysis of donkey sperm: Optimum frame rate and values of kinematic variables for different counting chamber and fields. Animals, 10(11), Article 1993. https://doi.org/10.3390/ani10111993
Gacem, S., Valverde, A., Catalán, J., Yánez Ortiz, I., Soler, C., & Miró, J. (2021). A new approach of sperm motility subpopulation structure in donkey and horse. Frontiers in Veterinary Science, 8, Article 651477. https://doi.org/10.3389/FVETS.2021.651477
Gallagher, M. T., Smith, D. J., & Kirkman-Brown, J. C. (2018). CASA: tracking the past and plotting the future. Reproduction, Fertility and Development, 30(6), 867–874. https://doi.org/10.1071/RD17420
Gallego, V., Vílchez, M. C., Peñaranda, D. S., Pérez, L., Herráez, M. P., Asturiano, J. F., & Martínez-Pastor, F. (2014). Subpopulation pattern of eel spermatozoa is affected by post-activation time, hormonal treatment and the thermal regimen. Reproduction, Fertility and Development, 27(3), 529–543. https://doi.org/10.1071/RD13198
García-Herreros, M. (2016). Sperm subpopulations in avian species: a comparative study between the rooster (Gallus domesticus) and Guinea fowl (Numida meleagris). Asian Journal of Andrology, 18(6), 889–894. https://doi.org/10.4103/1008-682X.188448
García-Molina, A., Navarro, N., Valverde, A., Bompart, D., Caldeira, C., Vendrell, A., & Soler, C. (2022). Human kinematic and morphometric sperm subpopulation analysis using CASA technology: A new approach to spermatozoa classification. Revista Internacional de Andrología, 20(4), 257–265. https://doi.org/10.1016/J.ANDROL.2021.05.003
García-Molina, A., Navarro, N., Valverde, A., Sadeghi, S., Garrido, N., & Soler, C. (2023). Optimization of human semen analysis using CASA-Mot technology. Systems Biology in Reproductive Medicine, 69(2), 166–174. https://doi.org/10.1080/19396368.2023.2170297
García-Molina, A., Valverde, A., Bompart, D., Caldeira, C., Vendrell, A., & Soler, C. (2020). Updating semen analysis: a subpopulation approach. Asian Journal of Andrology, 22(1), 118–119. https://doi.org/10.4103/aja.aja_33_19
Gomes, F. P., Park, R., Viana, A. G., Fernandez-Costa, C., Topper, E., Kaya, A., Memili, E., Yates, J. R., & Moura, A. A. (2020). Protein signatures of seminal plasma from bulls with contrasting frozen-thawed sperm viability. Scientific, 10, Article 14661. https://doi.org/10.1038/s41598-020-71015-9
Hidalgo, M. M. T., De Almeida, A. B. M., De Moraes, F. L. Z., Marubayashi, R. Y. P., De Souza, F. F., Barreiros, T. R. R., & Martins, M. I. M. (2021). Sperm subpopulations influence the pregnancy rates in cattle. Reproduction in Domestic Animals, 56(8), 1117–1127. https://doi.org/10.1111/RDA.13955
Hoflack, G., Opsomer, G., Van Soom, A., Maes, D., de Kruif, A., & Duchateau, L. (2006). Comparison of sperm quality of Belgian Blue and Holstein Friesian bulls. Theriogenology, 66(8), 1834–1846. https://doi.org/10.1016/J.THERIOGENOLOGY.2006.05.007
Holt, W. V., & Satake, N. (2018). Making the most of sperm activation responses: experiments with boar spermatozoa and bicarbonate. Reproduction, Fertility and Development, 30(6), 842–849. https://doi.org/10.1071/RD17476
Ibanescu, I., Siuda, M., & Bollwein, H. (2020). Motile sperm subpopulations in bull semen using different clustering approaches – Associations with flow cytometric sperm characteristics and fertility. Animal Reproduction Science, 215, Article 106329. https://doi.org/10.1016/j.anireprosci.2020.106329
Ibănescu, I., Leiding, C., & Bollwein, H. (2018). Cluster analysis reveals seasonal variation of sperm subpopulations in extended boar semen. Journal of Reproduction and Development, 64(1), 33–39. https://doi.org/10.1262/jrd.2017-083
Kathiravan, P., Kalatharan, J., Karthikeya, G., Rengarajan, K., & Kadirvel, G. (2011). Objective sperm motion analysis to assess dairy bull fertility using computer-aided system - A review. Reproduction in Domestic Animals, 46(1), 165–172. https://doi.org/10.1111/j.1439-0531.2010.01603.x
Koch, J., Weber, L. P., Heppelmann, M., Freise, F., Klingelmann, M., & Bachmann, L. (2022). Effect of different Thawing methods for frozen bull semen and additional factors on the conception rate of dairy cows in Artificial Insemination. Animals, 12(18), Article 2330. https://doi.org/10.3390/ANI12182330
Layek, S. S., Mohanty, T. K., Kumaresan, A., & Parks, J. E. (2016). Cryopreservation of bull semen: Evolution from egg yolk based to soybean based extenders. Animal Reproduction Science, 172, 1–9. https://doi.org/10.1016/J.ANIREPROSCI.2016.04.013
Martínez-Pastor, F. (2022). What is the importance of sperm subpopulations? Animal Reproduction Science, 246, Article 106844. https://doi.org/10.1016/J.ANIREPROSCI.2021.106844
Martínez-Pastor, F., Tizado, E. J., Garde, J. J., Anel, L., & de Paz, P. (2011). Statistical Series: Opportunities and challenges of sperm motility subpopulation analysis. Theriogenology, 75(5), 783–795. https://doi.org/10.1016/J.THERIOGENOLOGY.2010.11.034
Morrell, J. M., Valeanu, A. S., Lundeheim, N., & Johannisson, A. (2018). Sperm quality in frozen beef and dairy bull semen. Acta Veterinaria Scandinavica, 60, Article 41. https://doi.org/10.1186/S13028-018-0396-2
Mortimer, S. T., & De Jonge, C. J. (2018). CASA—Computer-Aided Sperm Analysis. In M. K. Skinner (Ed.), Encyclopedia of Reproduction (pp. 59–63). Elsevier. https://doi.org/10.1016/b978-0-12-801238-3.64935-8
Pichardo-Matamoros, D., Sevilla, F., Elizondo-Salazar, J., Jiménez-Sánchez, C., Roldan, E. R. S., Soler, C., Gacem, S., & Valverde, A. (2023). Exploration of semen quality analyzed by casa-mot systems of brahman bulls infected with BLV and BHV-1. Scientific Reports, 13, Article 18659. https://doi.org/10.1038/s41598-023-45981-9
Quintero-Moreno, A., Miró, J., Teresa Rigau, A., & Rodríguez-Gil, J. E. (2003). Identification of sperm subpopulations with specific motility characteristics in stallion ejaculates. Theriogenology, 59(9), 1973–1990. https://doi.org/10.1016/s0093-691x(02)01297-9
Quintero-Moreno, A., Rigau, T., & Rodríguez-Gil, J. (2007). Multivariate cluster analysis regression procedures as tools to identify motile sperm subpopulations in rabbit semen and to predict semen fertility and litter size. Reproduction in Domestic Animals, 42(3), 312–319. https://doi.org/10.1111/j.1439-0531.2006.00785.x
Ramón, M., & Martínez-Pastor, F. (2018). Implementation of novel statistical procedures and other advanced approaches to improve analysis of CASA data. Reproduction, Fertility and Development, 30(6), 860–866. https://doi.org/10.1071/RD17479
Schulze, M., Jakop, U., Jung, M., & Cabezón, F. (2019). Influences on thermo-resistance of boar spermatozoa. Theriogenology, 127, 15–20. https://doi.org/10.1016/J.THERIOGENOLOGY.2018.12.022
Selvaraju, S., Parthipan, S., Somashekar, L., Binsila, B. K., Kolte, A. P., Arangasamy, A., Ravindra, J. P., & Krawetz, S. A. (2018). Current status of sperm functional genomics and its diagnostic potential of fertility in bovine (Bos taurus). Systems Biology in Reproductive Medicine, 64(6), 484–501. https://doi.org/10.1080/19396368.2018.1444816
Shojaei, H., Kroetsch, T., Wilde, R., Blondin, P., Kastelic, J. P., & Thundathil, J. C. (2012). Moribund sperm in frozen-thawed semen, and sperm motion end points post-thaw and post-swim-up, are related to fertility in Holstein AI bulls. Theriogenology, 77(5), 940–951. https://doi.org/10.1016/J.THERIOGENOLOGY.2011.09.026
Sitko, E. M., Laplacette, A., Duhatschek, D., Rial, C., Perez, M. M., Tompkins, S., Kerwin, A. L., & Giordano, J. O. (2024). Reproductive physiological outcomes of dairy cows with different genomic merit for fertility: biomarkers, uterine health, endocrine status, estrus features, and response to ovarian synchronization. Journal of Dairy Science, 107(10), 8670–8687. https://doi.org/10.3168/JDS.2023-24376
Soler, C., Alambiaga, A., Martí, M. A., García-Molina, A., Valverde, A., Contell, J., & Campos, M. (2017). Dog sperm head morphometry: its diversity and evolution. Asian Journal of Andrology, 19(2), 149–153. https://doi.org/10.4103/1008-682X.189207
Soler, C., Contell, J., Bori, L., Sancho, M., García-Molina, A., Valverde, A., & Segarvall, J. (2017). Sperm kinematic, head morphometric and kinetic-morphometric subpopulations in the blue fox (Alopex lagopus). Asian Journal of Andrology, 19(2), 154–159. https://doi.org/10.4103/1008-682X.188445
Soler, C., Valverde, A., Bompart, D., Fereidounfar, S., Sancho, M., Yániz, J. L., García-Molina, A., & Korneenko-Zhilyaev, Yu. A. (2017). New methods of semen analysis by casa. Sel’skokhozyaistvennaya Biologiya (Agricultural Biology), 52(2), 232–241. https://doi.org/10.15389/agrobiology.2017.2.232eng
Solís, J. M., Sevilla, F., Silvestre, M. A., Araya-Zúñiga, I., Roldan, E. R. S., Saborío-Montero, A., & Valverde, A. (2024). Effect of thawing procedure and thermo-resistance test on sperm motility and kinematics patterns in two bovine breeds. Animals, 14(19), Article 2768. https://doi.org/10.3390/ANI14192768
Stefanska, B., Sobolewska, P., Fievez, V., Pruszynska-Oszmałek, E., Purwin, C., & Nowak, W. (2024). The effect of heat stress on performance, fertility, and adipokines involved in regulating systemic immune response during lipolysis of early lactating dairy cows. Journal of Dairy Science, 107(4), 2111–2128. https://doi.org/10.3168/JDS.2023-23804
Valverde, A., Arenán, H., Sancho, M., Contell, J., Yániz, J., Fernández, A., & Soler, C. (2016). Morphometry and subpopulation structure of Holstein bull spermatozoa: variations in ejaculates and cryopreservation straws. Asian Journal of Andrology, 18(6), 851–857. https://doi.org/10.4103/1008-682X.187579
Valverde, A., Arnau, S., García-Molina, A., Bompart, D., Campos, M., Roldán, E., & Soler, C. (2019). Dog sperm swimming parameters analysed by computer-assisted semen analysis of motility reveal major breed differences. Reproduction in Domestic Animals, 54(5), 795–803. https://doi.org/10.1111/rda.13420
Valverde, A., Barquero, V., & Soler, C. (2020). The application of computer-assisted semen analysis (CASA) technology to optimise semen evaluation. A review. Journal of Animal and Feed Sciences, 29(3), 189–198. https://doi.org/10.22358/jafs/127691/2020
Valverde, A., Castro-Morales, O., Madrigal-Valverde, M., Camacho, M., Barquero, V., Soler, C., & Roldan, E. R. S. (2021). Sperm kinematic subpopulations of the American crocodile (Crocodylus acutus). PLOS ONE, 16(3), Article e0248270. https://doi.org/10.1371/journal.pone.0248270
Valverde, A., Castro-Morales, O., Madrigal-Valverde, M., & Soler, C. (2019). Sperm kinematics and morphometric subpopulations analysis with CASA systems: A review. Revista de Biología Tropical, 67(6), 1473–1487. https://doi.org/10.15517/rbt.v67i6.35151
Valverde, A., Madrigal, M., Caldeira, C., Bompart, D., Núñez de Murga, J., Arnau, S., & Soler, C. (2019). Effect of frame rate capture frequency on sperm kinematic parameters and subpopulation structure definition in boars, analysed with a CASA-Mot system. Reproduction in Domestic Animals, 54(2), 167–175. https://doi.org/10.1111/rda.13320
Valverde, A., Madrigal-Valverde, M., Castro-Morales, O., Gadea-Rivas, A., Johnston, S., & Soler, C. (2019). Kinematic and head morphometric characterisation of spermatozoa from the Brown Caiman (Caiman crocodilus fuscus). Animal Reproduction Science, 207, 9–20. https://doi.org/10.1016/j.anireprosci.2019.06.011
van der Horst, G. (2020). Computer Aided Sperm Analysis (CASA) in domestic animals: Current status, three D tracking and flagellar analysis. Animal Reproduction Science, 220, Article 106350. https://doi.org/10.1016/j.anireprosci.2020.106350
Vázquez, A. J. F., Cedillo, M. J., Quezada, V. J., Rivas, A. C., Morales, E. C. L., Ayala, E. M. E., Hernández, M. J., González, R. A., & Aragón, M. A. (2015). Effects of repeated electroejaculations on kinematic sperm subpopulations and quality markers of Mexican creole goats. Animal Reproduction Science, 154, 29–38. https://doi.org/10.1016/j.anireprosci.2014.12.009
Víquez, L., Barquero, V., Soler, C., Roldan, E. R. S., & Valverde, A. (2020). Kinematic sub-populations in bull spermatozoa: A comparison of classical and Bayesian approaches. Biology, 9(6), Article 138. https://doi.org/10.3390/biology9060138
Víquez, L., Barquero, V., & Valverde, A. (2021). Optimal conditions for the kinematic analysis in fresh semen of Brahman bulls with a CASA-Mot system. Agronomía Mesoamericana, 32(3), 920–938. https://doi.org/10.15517/AM.V32I3.42768
Winters, R. A., Hamilton, D. N., Bhatnagar, A. S., Fitzgerald, R., Bovin, N., & Miller, D. J. (2018). Porcine sperm binding to oviduct cells and glycans as supplements to traditional laboratory semen analysis. Journal of Animal Science, 96(12), 5265–5275. https://doi.org/10.1093/jas/sky372
Yánez-Ortiz, I., Catalán, J., Rodríguez-Gil, J. E., Miró, J., & Yeste, M. (2022). Advances in sperm cryopreservation in farm animals: Cattle, horse, pig and sheep. Animal Reproduction Science, 246, Article 106904. https://doi.org/10.1016/J.ANIREPROSCI.2021.106904
Yániz, J. L., Palacín, I., Caycho, K. S., Soler, C., Silvestre, M. A., & Santolaria, P. (2018). Determining the relationship between bull sperm kinematic subpopulations and fluorescence groups using an integrated sperm quality analysis technique. Reproduction, Fertility and Development, 30(6), 919–923. https://doi.org/10.1071/RD17441
Yániz, J. L., Palacín, I., Vicente-Fiel, S., Sánchez-Nadal, J., & Santolaria, P. (2015). Sperm population structure in high and low field fertility rams. Animal Reproduction Science, 156, 128–134. https://doi.org/10.1016/j.anireprosci.2015.03.012
Yániz, J. L., Silvestre, M. A., Santolaria, P., & Soler, C. (2018). CASA-Mot in mammals: an update. Reproduction, Fertility, and Development, 30(6), 799–809. https://doi.org/10.1071/RD17432

Esta obra está bajo una licencia de Creative Commons Reconocimiento-NoComercial-SinObraDerivada 4.0 Internacional.
Puede hallar permisos más allá de los concedidos con esta licencia en pccmca@gmail.com