Agronomía Mesoamericana
Artículo científico
Volumen 36: Artículo 61996, 2025
e-ISSN 2215-3608, https://doi.org/10.15517/am.2025.61996
https://revistas.ucr.ac.cr/index.php/agromeso/index
Efecto de Bacillus spp. como bioestimulante de microvegetales de Brassica oleracea var. capitata y Brassica oleracea var. sabellica*
Effect of Bacillus spp. as a biostimulant for Brassica oleracea var. capitata and Brassica oleracea var. sabellica microgreens
Aldo Gutiérrez-Chávez1, Angélica Anahí Acevedo-Barrera1, Rosa María Yañez-Muñoz1, Jared Hernández-Huerta1
* Recepción: 23 de septiembre, 2024. Aceptación: 27 de enero, 2025. Este trabajo formó parte de un proyecto de investigación. Se efectuó en la Facultad de Ciencias Agrotecnológicas de la Universidad Autónoma de Chihuahua (UACH), en Chihuahua, México. Fue financiado por la UACH.
1 Universidad Autónoma de Chihuahua, Facultad de Ciencias Agrotecnológicas. Chihuahua, México. agutierrezc@uach.mx (https://orcid.org/0009-0002-5343-3320); aacevedo@uach.mx (https://orcid.org/0000-0001-5547-7090); rosky1388@gmail.com (https://orcid.org/0000-0001-5571-0139); jahuerta@uach.mx (autor para correspondencia; https://orcid.org/0000-0003-4634-2172).
Resumen
Introducción. El género Bacillus se ha empleado como bioestimulante con efectos positivos sobre el rendimiento y calidad de los cultivos. Sin embargo, existen pocos estudios acerca de su aplicación en microvegetales. Objetivo. Evaluar el efecto de Bacillus subtilis (BsC4 y BsPC) y Bacillus thuringiensis (Bt24) como bioestimulantes de la germinación y desarrollo de microvegetales de col morada (Brassica oleracea var. capitata) y kale (Brassica oleracea var. sabellica) en condiciones controladas. Materiales y métodos. El estudio se realizó en la Universidad Autónoma de Chihuahua, México, durante 2023. Se evaluaron cuatro tratamientos: Bt24, BsC4, BsPC y plántulas sin microorganismos (control) en semillas de col morada y kale, bajo un diseño completamente al azar (n = 5). En un primer ensayo se monitorizó la germinación, y en un segundo, el desarrollo de los microvegetales. Después de 15 días se midieron variables morfológicas, pigmentos fotosintéticos, contenido de nitratos, calidad y rendimiento. Los datos se analizaron con análisis de varianza y pruebas de Tukey (p < 0,05). Resultados. Para kale, Bt24 mejoró la velocidad de germinación (31,17 %) y redujo el tiempo de germinación (4,61 %), sin efecto significativo en col morada. En kale, el rendimiento aumentó (62,60 %) con Bt24, en particular la biomasa fresca (63,30 %) y el área cotiledonar (61,57 %). En col morada, BsC4 incrementó el rendimiento (44,31 %), además de mejorar biomasa fresca (42,21 %) y área cotiledonar (50,57 %). El contenido de nitratos fue más elevado en kale con BsPC (138,30 %) y en col morada con Bt24 (65,14 %), sin exceder límites seguros. En calidad visual, ambos cultivos alcanzaron las categorías “Bueno” y “Excelente”, sin diferencias entre tratamientos. Conclusiones. B. thuringiensis y B. subtilis podrían emplearse como bioestimulantes del crecimiento de microvegetales de col morada y kale, una herramienta prometedora para optimizar su producción en condiciones controladas.
Palabras clave: bioestimulantes, brásicas, microvegetales, rendimiento.
Abstract
Introduction. The Bacillus genus has been used as a biostimulant with positive effects on crop yield and quality. However, there are few studies on its application in microgreens. Objective. To evaluate the effect of Bacillus subtilis (BsC4 and BsPC) and Bacillus thuringiensis (Bt24) as biostimulants on the germination and growth of red cabbage (Brassica oleracea var. capitata) and kale (Brassica oleracea var. sabellica) microgreens under controlled environmental conditions. Materials and methods. The study was conducted at the Universidad Autónoma de Chihuahua, Mexico, in 2023. Four treatments were assessed: Bt24, BsC4, BsPC, and seedlings without microorganisms (control) on red cabbage and kale seeds, under a completely randomized design (n = 5). Germination was monitored in the first trial, and microgreens development was assessed in the second. After 15 days, morphological variables, photosynthetic pigments, nitrate content, quality, and yield were measured. Data were analyzed using analysis of variance and Tukey’s tests (p < 0.05). Results. For kale, Bt24 improved germination speed (31.17 %) and reduced germination time (4.61 %), with no significant effect on red cabbage. In kale, yield increased (62.60 %) with Bt24, particularly in fresh biomass (63.3 %) and cotyledon area (61.57 %). In cabbage, BsC4 increased yield (44.31 %) and improved fresh biomass (42.21 %) and cotyledon area (50.57 %). Nitrate content was highest in kale with BsPC (138.30 %) and in red cabbage with Bt24 (65.14 %), while remaining within safe consumption limits. For visual quality, both crops achieved the “Good” and “Excellent” categories, with no differences between treatments. Conclusions. B. thuringiensis and B. subtilis could be used as growth biostimulants for cabbage and kale microgreens, offering a promising approach to optimize microgreen production under controlled environmental conditions.
Keywords: biostimulants, brassicas, microgreens, yield.
Introducción
Los microvegetales son plántulas jóvenes de hortalizas, hierbas aromáticas o especies silvestres comestibles cosechadas entre 10 y 14 días después de su siembra (Mir et al., 2017). En los últimos años, han ganado popularidad en todo el mundo debido a sus sabores intensos, texturas crujientes y colores vistosos (Benincasa et al., 2019; Tan et al., 2020). Tienen un alto contenido de nutrientes y compuestos bioactivos benéficos para la salud humana (Di Gioia et al., 2017; Paradiso et al., 2018).
Entre los microvegetales más populares destacan las brasicáceas, como el brócoli (Brassica oleracea var. italica), la coliflor (B. oleracea var. botrytis), las coles de Bruselas (B. oleracea var. gemmifera), la col (B. oleracea var. capitata) y el kale (B. oleracea var. sabellica) (Ebert, 2022; Xiao et al., 2019). Su popularidad se debe a su riqueza en compuestos fitoquímicos y propiedades funcionales (Alloggia et al., 2023). Los microvegetales de brásicas son ricos en antioxidantes como el ácido ascórbico, carotenoides y compuestos fenólicos, además de contener compuestos bioactivos como glucosinolatos, isotiocianatos e indoles, importantes en la prevención de enfermedades (Fusari et al., 2020; Ramirez et al., 2020).
Existe un creciente interés por mejorar la germinación, el rendimiento y la calidad de los microvegetales (Katsenios et al., 2021; Kyriacou et al., 2016). Algunos estudios han evaluado agentes físicos y químicos como tratamientos para semillas, con resultados positivos en la germinación y desarrollo de las plántulas; por ejemplo, Lee et al. (2004) lograron una mejora significativa en la germinación de betabel (Beta vulgaris subsp. vulgaris) y acelga (Beta vulgaris subsp. vulgaris var. cicla) al tratar las semillas con sustancias como el cloruro de hidrógeno, peróxido de hidrógeno e hipoclorito de sodio. Por su parte, Saengha et al. (2021) demostraron que el uso de plasma frío aumenta la germinación y el crecimiento de microvegetales de mostaza (Brassica nigra).
Una alternativa que ha sido estudiada de manera limitada es el uso de microorganismos como bioestimulantes en la producción de microvegetales. Los bioestimulantes microbianos, que incluyen una variedad de especies de bacterias y hongos benéficos, tienen la capacidad de mejorar la germinación y el desarrollo de plantas (Waguespack et al., 2022). En particular, los bioestimulantes de origen bacteriano han demostrado beneficios significativos en el desarrollo vegetal de diversos cultivos (Hernández-Valladares et al., 2021).
Las bacterias como bioestimulantes promueven el crecimiento de las plantas mediante la producción de fitohormonas como las auxinas y citoquininas, la solubilización de nutrientes como el fósforo, y la síntesis de sideróforos que mejoran la absorción de nutrientes (González & Fuentes, 2017). Asimismo, contribuyen a la protección frente a patógenos con metabolitos antimicrobianos y fortalecen la tolerancia de las plantas al estrés abiótico, como la sequía o salinidad, a través de la modulación de rutas de señalización (Ilangumaran & Smith, 2017; Santoyo et al., 2021; Vela-Corcia et al., 2024). Además, pueden reducir sustancias perjudiciales en las plantas, como metales pesados, compuestos tóxicos o nitratos, disminuyendo su impacto en la salud humana (Ghosh et al., 2022; Trujillo Peralta et al., 2023).
A pesar de los múltiples beneficios de las bacterias como bioestimulantes en diversos cultivos y sistemas de producción, su aplicación en microvegetales ha sido limitada. El género Bacillus es reconocido por su capacidad para promover el crecimiento vegetal, en cultivos convencionales y sistemas hidropónicos (Da Silva Oliveira et al., 2023; Tsotetsi et al., 2022; Weinand et al., 2023). Sin embargo, solo algunos estudios han evaluado su efecto en microvegetales. Por ejemplo, Bacillus velezensis incrementó la germinación en un 23,8 % y la biomasa fresca en un 55,7 % en microvegetales de chile (Capsicum annuum) (Wang et al., 2024), y la combinación de Bacillus megaterium con Azotobacter chroococcum y Pseudomonas fluorescens mejoró la longitud y el valor nutricional de brotes de chícharo (Pisum sativum) (Eissa et al., 2018).
Por lo anterior, el presente estudio tuvo como objetivo evaluar el efecto de Bacillus subtilis (BsC4 y BsPC) y Bacillus thuringiensis (Bt24) como bioestimulantes de la germinación y desarrollo de microvegetales de col morada (Brassica oleracea var. capitata) y kale (Brassica oleracea var. sabellica) en condiciones controladas.
Materiales y métodos
Ubicación del experimento y material vegetal
El ensayo se realizó en el Laboratorio de Microbiología Aplicada, Fitopatología y Fisiología Postcosecha (MAFFP) de la Facultad de Ciencias Agrotecnológicas de la Universidad Autónoma de Chihuahua (UACH) durante noviembre y diciembre de 2023. Se emplearon semillas comerciales para microvegetales de col morada y kale de la empresa Falcon Seeds® S. de R. L. de C. V., seleccionadas por su disponibilidad comercial y adaptabilidad al cultivo en condiciones controladas.
Diseño experimental
El experimento se estableció bajo un diseño completamente al azar para evaluar el efecto de bacterias del género Bacillus sobre parámetros de germinación, características morfológicas y bioquímicas, así como sobre la calidad y el rendimiento de microvegetales de col morada y kale en condiciones controladas (n = 5). Los tratamientos incluyeron semillas inoculadas con B. subtilis BsC4 y B. thuringiensis Bt24 pertenecientes al cepario del laboratorio MAFFP, UACH. Como controles, se utilizaron semillas sin inoculación y la cepa comercial B. subtilis QST713 (BsPC), reaislada del producto Serenade®, la cual ha demostrado actividad bioestimulante en chile (Capsicum annuum) y lechuga (Lactuca sativa) en estudios efectuados en el mismo laboratorio.
Preparación de inóculos bacterianos
Las cepas de Bacillus, incluida la del producto comercial, se cultivaron en caldo nutritivo a 28 °C durante 72 h bajo agitación continua a 120 rpm. Posteriormente, los cultivos se sometieron a un tratamiento térmico a 80 °C durante 10 min y se centrifugaron a 7000 rpm durante 10 min a 4 °C (Kanjanamaneesathian et al., 2014). El sedimento (pellet) se resuspendió en 20 mL de agua destilada estéril. Este procedimiento se repitió dos veces, ajustando las suspensiones bacterianas a 1 × 108 unidades formadoras de colonias (UFC)/mL, mediante densidad óptica de 0,4 a 600 nm (espectrofotómetro UV-visible) (Chandrasekaran et al., 2017).
Promoción de la germinación
Esta prueba evaluó la germinación in vitro de semillas de col morada y kale. Las semillas fueron esterilizadas de manera superficial con NaClO al 4 % (v/v) durante 5 min, seguido de tres enjuagues consecutivos con agua destilada estéril. Posteriormente, las semillas se inocularon mediante inmersión con las cepas de Bacillus (120 rpm por 1 h). Después de la inoculación, las semillas se secaron y se colocaron 30 de cada especie en cajas Petri acondicionadas con círculos de papel secante estéril y se añadieron 5 mL de agua destilada estéril por caja. Las cajas se sellaron con Parafilm® y se colocaron en un cuarto de crecimiento a 25 ± 2 °C, durante 6 días. Durante el ensayo, se evaluaron los parámetros relacionados con la germinación.
Promoción del crecimiento de microvegetales
Para esta prueba, las semillas de col morada y kale inoculadas previamente con las bacterias se colocaron en cajas Petri estériles. Cada caja contenía tres capas de papel absorbente estéril humedecidas con 10 mL de agua destilada estéril. Las semillas se distribuyeron de manera uniforme sobre el papel, en una densidad de siembra equivalente a 83,1 g/m2 para col morada y de 75,6 g/m2 para kale, de acuerdo con las recomendaciones descritas por Li et al. (2021). Las cajas sembradas se colocaron en un cuarto de crecimiento con un fotoperiodo de 16 h de luz a 28 °C y 8 h de oscuridad a 18 °C, bajo una intensidad luminosa de 3500 lux proporcionada por luces LED blancas (Goodwill az-energy®) y con una humedad relativa de 70 ± 2 %. Las cajas fueron monitorizadas diariamente y regadas cada tercer día con 5 mL de agua destilada estéril.
Parámetros de germinación
La germinación de las semillas se expresó al finalizar la evaluación como el porcentaje de semillas germinadas empleando la ecuación 1 de Al-Ansari y Ksiksi (2016).
 (1)
(1)
El tiempo medio de germinación (TMG) fue calculado usando la ecuación 2 propuesta por Ranal y Garcia de Santana (2006).
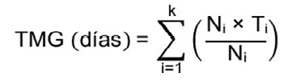 (2)
(2)
Donde, TMG = tiempo medio de germinación en días; Ni = número de semillas germinadas en un día; Ti = tiempo transcurrido (en días) desde el inicio del experimento hasta la i-ésima observación, y k = último día de germinación.
La velocidad media de germinación (VMG) fue determinada usando la ecuación 3 propuesta por Wardle et al. (1991).
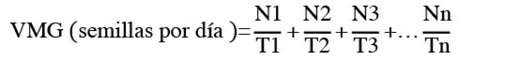 (3)
(3)
Donde, N1, N2, N3… Nn = número de semillas germinadas por día; T1, T2, T3, … Tn = tiempo después de la siembra.
Parámetros morfológicos
Las características morfológicas de los microvegetales fueron determinadas 15 días después de la siembra (dds). En cada especie evaluada y en cada repetición, se seleccionaron al azar cinco plántulas de la parte media de la caja Petri. Las plántulas se cortaron a nivel del cuello para realizar las mediciones. Las plántulas se cortaron a nivel del cuello para realizar las mediciones. La altura del hipocótilo (cm) se determinó desde la base del cuello hasta el punto de inserción de los cotiledones. Otras mediciones incluyeron el diámetro de hipocótilo (mm), el área cotiledonal (cm2) determinada con el software ImageJ, y la biomasa fresca (mg) y seca (mg) de cada parte de la plántula. La biomasa seca se obtuvo después de secar las muestras a 40 °C durante dos días.
Contenido de pigmentos fotosintéticos
El contenido de pigmentos fotosintéticos fue determinado 15 dds según la metodología de Lichtenthaler y Wellburn (1983). Se tomaron 0,1 g de hojas cotiledonares frescas, a las cuales se les añadieron 4 mL de acetona al 80 % (v/v). La mezcla se trituró y se centrifugó a 3000 rpm por 5 min. La absorbancia del sobrenadante fue medida a 663, 470 y 645 nm usando un espectrofotómetro UV. Los cálculos de las concentraciones de pigmentos se determinaron con las ecuaciones 4, 5 y 6.
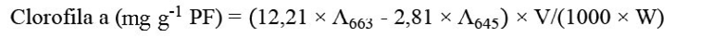 (4)
(4)
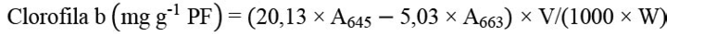 (5)
(5)
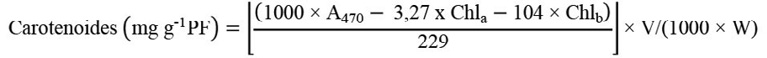 (6)
(6)
Donde V = volumen en mL de acetona al 80 % y PF = peso fresco de hojas cotiledonares en gramos.
Contenido de nitratos
El contenido de nitratos se determinó siguiendo la metodología descrita por Cataldo et al. (1975). Para ello, se hirvieron 0,5 g de muestra seca durante 30 min en 5 mL de agua destilada a fin de obtener un extracto, que luego se filtró. Posteriormente, se añadieron 0,8 mL de ácido salicílico al 5 % (p/v) en H2SO4 concentrado a 0,2 mL del extracto. Después de 20 min, se incorporaron 19 mL de solución de NaOH 2N, y la absorbancia se midió a 410 nm con un espectrofotómetro UV-visible. La concentración de nitratos se calculó a partir de una curva estándar de KNO3 (10-100 μg/g).
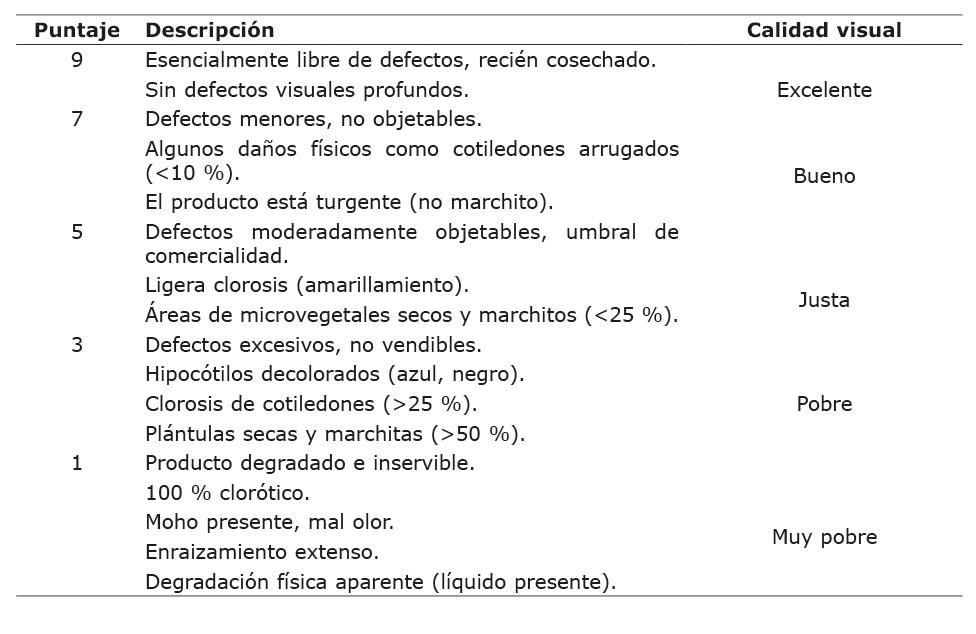
Calidad de microvegetales
La calidad de los microvegetales se evaluó 15 dds según la escala propuesta por Rennie et al. (2001) (Cuadro 1).
Cuadro 1. Escala de evaluación de la calidad de microvegetales basada en el análisis visual del producto, Universidad Autónoma de Chihuahua, México, 2023.
Table 1. Microgreens quality evaluation scale based on visual analysis of the product, Universidad Autónoma de Chihuahua, Mexico, 2023.
Rendimiento
El rendimiento de los microvegetales fue calculado empleando la ecuación 7.
 (7)
(7)
Donde: 32,869 plántulas/m2 para kale y 18,886 plántulas/m2 para col morada.
Análisis estadístico
Los datos de los parámetros de germinación, características morfológicas, bioquímicas y de rendimiento se sometieron a las pruebas de Shapiro-Wilk y Levene. Los datos que no cumplieron con la prueba de Levene fueron transformados mediante la función Box-Cox para cumplir con la homocedasticidad (Wan et al., 2008). Posteriormente, se ejecutó un análisis de varianza (ANDEVA) y pruebas de Tukey (p < 0,05). Los resultados de la calidad de los microvegetales se analizaron con tablas de contingencia y la prueba de Chi-cuadrada (García et al., 1996). El procesamiento de datos se realizó por medio del software JAMOVI 2.5.2.0 (The Jamovi Projet, s. f.).
Resultados
Promoción de la germinación en microvegetales
Los resultados del ANDEVA indicaron que ninguno de los tratamientos bacterianos afectó significativamente (p < 0,05) la germinación de semillas de col morada. Sin embargo, en el caso de kale, estos tratamientos tuvieron un efecto significativo en la velocidad y el tiempo de germinación (Cuadro 2).
Cuadro 2. Efecto de tratamientos microbianos sobre variables de germinación de semillas de col morada y kale bajo condiciones in vitro, Universidad Autónoma de Chihuahua, México, 2023.
Table 2. Effect of microbial treatments on germination variables of red cabbage and kale seeds under in vitro conditions, Universidad Autónoma de Chihuahua, Mexico, 2023.
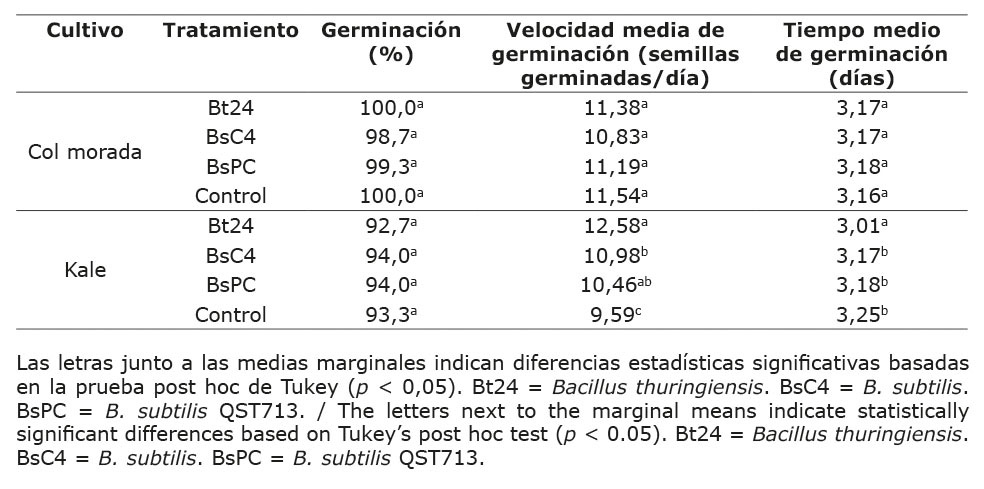
En el caso de la col morada, los resultados del ANDEVA mostraron que todos los tratamientos, incluido el control, presentaron porcentajes de germinación cercanos al 100 %, sin diferencias estadísticas significativas entre ellos, con una media de 99,50 % (Cuadro 2). La velocidad media de germinación y el tiempo medio de germinación no se vieron afectados de manera significativa por los tratamientos microbianos, y se obtuvo una media general de 11,23 semillas de col morada germinadas por día y 3,17 días para la germinación.
El ANDEVA reveló diferencias significativas (p < 0,05) entre los tratamientos bacterianos y el kale en la velocidad media de germinación y el tiempo medio de germinación (Cuadro 2). Aunque no se observaron diferencias significativas en el porcentaje de germinación (media de 93,5 %), sí hubo variaciones significativas en la velocidad media de germinación. El tratamiento con Bt24 destacó con 12,58 semillas germinadas por día, seguido por BsC4 y BsPC, que incrementaron este parámetro entre 9,07 % y 31,17 %, respectivamente, en comparación con el control. En cuanto al tiempo medio de germinación, Bt24 fue el único que influyó, con una reducción del 4,61 %, alcanzando un valor de 3,01 días.
Promoción del crecimiento de los microvegetales
El ANDEVA del efecto de las cepas de Bacillus evaluadas sobre los parámetros morfológicos de los microvegetales mostró diferencias significativas (p < 0,05) en todos los parámetros entre los tratamientos bacterianos y en ambos cultivos (Cuadro 3).
Cuadro 3. Efecto de tratamientos microbianos sobre variables morfológicas de plántulas de kale y col morada bajo condiciones controladas a los 15 días de su inoculación, Universidad Autónoma de Chihuahua, México, 2023.
Table 3. Effect of microbial treatments on morphological variables of kale and red cabbage under controlled environmental conditions 15 days after inoculation, Universidad Autónoma de Chihuahua, Mexico, 2023.
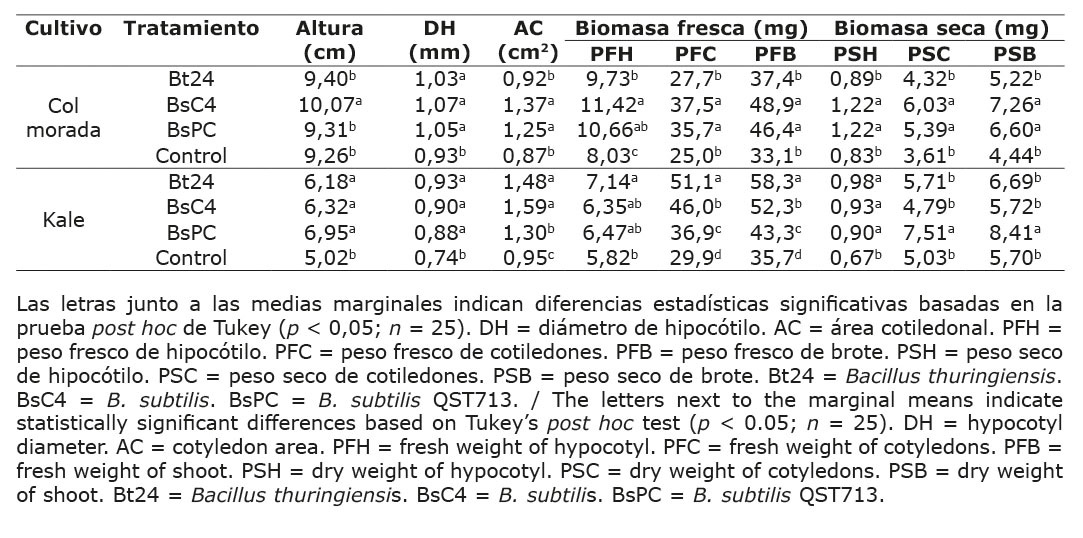
En col morada, el tratamiento con BsC4 presentó el mejor desempeño en altura del hipocótilo, con un promedio de 10,07 cm, lo que representa un aumento del 8,74 % respecto al control (9,26 cm). El diámetro de hipocótilo creció un 12,90 % en los tratamientos Bt24, BsC4 y BsPC, con un promedio de 1,05 mm, mientras que el control mostró valores menores (0,93 mm). Además, el área cotiledonar fue significativamente mayor en BsC4 y BsPC, con un promedio de 1,31 cm2, un incremento del 50,57 % frente al control (0,895 cm2).
La biomasa fresca del hipocótilo mejoró con BsC4, que registró el mayor incremento con 11,42 mg, equivalente a un 42, 21 % más que el control (8,03 mg), seguido de BsPC y Bt24, con aumentos del 32,75 % y 21,17 %, respectivamente. El peso fresco de los cotiledones fue significativamente superior con BsC4 y BsPC, alcanzando un promedio de 36,6 mg, un 46,40 % más en comparación con Bt24 y el control (26,35 mg). La biomasa fresca de brote fue mayor con BsC4 y BsPC, alcanzando un promedio de 47,65 mg, lo que representó un aumento del 43,95 % respecto al control (33,1 mg).
En biomasa seca, BsC4 y BsPC mostraron incrementos notables en peso seco de hipocótilo (1,22 mg), cotiledones (5,71 mg) y brote (6,93 mg). Estos aumentos corresponden a un 46,99 %, 58,17 % y 56,08 %, respectivamente. Por otro lado, Bt24 fue estadísticamente igual al control en todos los parámetros de biomasa seca.
En kale, los tres tratamientos bacterianos incrementaron la altura y el diámetro del hipocótilo en un 29,15 % y 22,07 %, respectivamente, en comparación con el control, con promedios de 6,48 cm y 0,90 mm. El área cotiledonar aumentó significativamente con los tratamientos Bt24 y BsC4, que lograron un promedio de 1,54 cm2 (61,57 % más que el control). El tratamiento BsPC también mejoró este parámetro en un 36,84 %, con un promedio de 1,30 cm2.
La biomasa fresca del hipocótilo fue mayor con Bt24, con 7,14 mg, lo que representó un aumento del 22,68 % respecto al control. En peso fresco de cotiledones y brote, todos los tratamientos superaron al control, destacando Bt24 con 51,1 mg y 58,3 mg, incrementos del 70,90 % y 63,30 %, respectivamente. BsC4 mostró aumentos del 53,84 % y 46,50 %, en estos parámetros, mientras que BsPC registró incrementos del 23,41 % y 21,28 %.
En cuanto a biomasa seca, el peso seco de hipocótilo creció un 39,80 %, con 0,94 mg en promedio en todos los tratamientos bacterianos. Solo el tratamiento BsPC mejoró significativamente el peso seco de cotiledones y brote. Estos incrementos fueron del 49,30 % y 47,54 %, alcanzando 7,51 mg y 8,41 mg, respectivamente.
Efecto de Bacillus sobre los pigmentos fotosintéticos de los microvegetales
Los resultados del ANDEVA indican que los tratamientos bacterianos evaluados afectan significativamente (p < 0,05) el contenido de pigmentos fotosintéticos en los microvegetales de col morada y kale, cultivados bajo condiciones controladas (Cuadro 4).
Cuadro 4. Efecto de tratamientos microbianos sobre el contenido de pigmentos fotosintéticos en plántulas de kale y col morada bajo condiciones controladas a los 15 días de su inoculación, Universidad Autónoma de Chihuahua, México, 2023.
Table 4. Effect of microbial treatments on photosynthetic pigment content of kale and red cabbage under controlled environmental conditions 15 days after inoculation, Universidad Autónoma de Chihuahua, México, 2023.
En el caso de la col morada, las cepas de Bacillus evaluadas no generaron efectos significativos sobre el contenido de clorofila a ni carotenoides. Se registró un promedio de 0,359 mg/g de peso fresco (PF) y 0,782 mg/g PF, respectivamente. Sin embargo, el contenido de clorofila b mostró un promedio de 0,124 mg/g PF con el tratamiento BsC4, lo que representó un incremento del 49,39 % en comparación con el control, cuyo promedio fue de 0,083 mg/g PF (Cuadro 4).
En el caso de kale, los tratamientos Bt24 y BsC4 redujeron significativamente el contenido de clorofila a, registrando un promedio de 0,168 mg/g PF, en comparación con el control, que presentó un promedio de 0,381 mg/g PF, equivalente a una disminución del 55,91 %. Estos mismos tratamientos afectaron de forma significativa el contenido de clorofila b, con un promedio de 0,049 mg/g PF, lo que representa una reducción del 48,96 %, respecto al control (0,096 mg/g PF).
Bt24 y BsC4 también afectaron de manera significativa el contenido de carotenoides, alcanzando un promedio de 0,470 mg/g PF. Este valor corresponde a una disminución del 39,14 % en comparación con el control, cuyo promedio fue de 0,787 mg/g PF. El tratamiento BsPC no mostró efectos significativos en ninguno de los pigmentos fotosintéticos y se mantuvo en niveles similares al control (Cuadro 4).
Efecto de Bacillus sobre el contenido de nitratos de los microvegetales
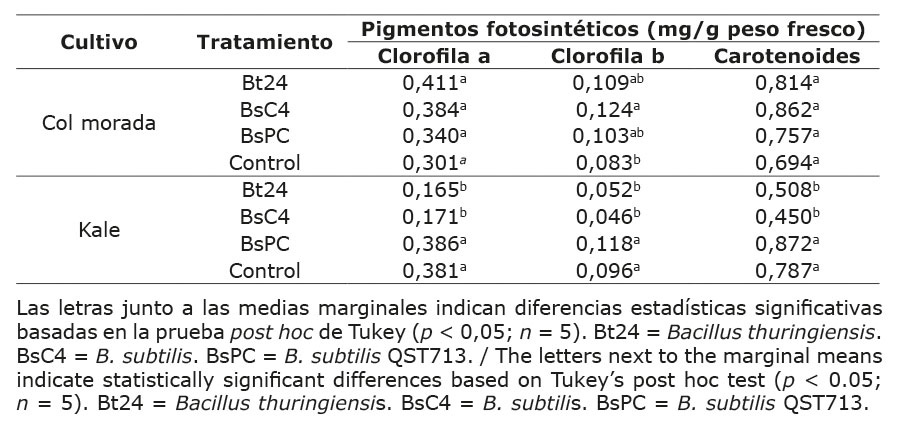
El contenido de nitratos en los dos tipos de microvegetales presentó diferencias significativas (p < 0,05) debido a la aplicación de tratamientos microbianos. En el caso de la col morada, el tratamiento Bt24 resultó en un contenido promedio de nitratos de 4923 mg NO3/kg de PF, lo que representó un incremento del 65,14 % en comparación con los tratamientos BsC4 y BsPC, que mostraron valores similares entre sí, con un promedio de 2981 mg NO3/kg de PF. El control fue similar a los tratamientos bacterianos, con un contenido promedio de nitratos de 3739 mg NO3/kg de PF (Figura 1a).
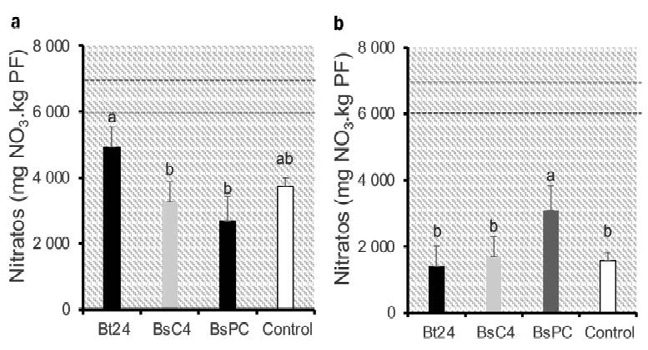
Figura 1. Contenido de nitratos en microvegetales de col morada (a) y kale (b) tratados con Bacillus spp. bajo condiciones controladas a los 15 días de la inoculación, Universidad Autónoma de Chihuahua, México, 2023.
Las líneas horizontales representan los límites máximos permitidos de nitratos en otras especies de brásicas, como la arúgula (Eruca vesicaria), según la regulación 1258/2011 de la Unión Europea. Las barras con letras distintas indican diferencias estadísticas significativas (p < 0,05) de acuerdo con la prueba de Tukey. Bt24 = Bacillus thuringiensis. BsC4 = B. subtilis. BsPC = cepa comercial de B. subtilis QST713.
Figure 1. Nitrate content in red cabbage (a) and kale (b) microgreens treated with Bacillus spp. under environmental controlled conditions at 15 days post-inoculation, Universidad Autónoma de Chihuahua, Mexico, 2023.
Horizontal lines indicate maximum permissible nitrate concentrations in other Brassica species, such as arugula (Eruca vesicaria), according to European Union Regulation 1258/2011. Bars with different letters indicate statistically significant differences (p < 0.05) based on Tukey’s test. Bt24 = Bacillus thuringiensis. BsC4 = B. subtilis. BsPC = commercial strain of B. subtilis QST713.
En el caso del kale, el contenido de nitratos tuvo un incremento significativo con el tratamiento BsPC, alcanzando un promedio de 3088 mg NO3/kg de PF. Este valor representa un aumento del 138,3 % en comparación con el control, cuyo contenido fue de 1569 mg NO3/kg de PF. Los tratamientos Bt24 y BsC4 no mostraron diferencias estadísticas significativas respecto al control, con un promedio de 1544 mg NO3/kg de PF (Figura 1b).
Efecto de Bacillus sobre la calidad de los microvegetales
La calidad visual de los microvegetales no se vio afectada por ninguno de los tratamientos bacterianos (Figura 2a). En la col morada, los tallos presentaron un color púrpura intenso y las hojas exhibieron un desarrollo uniforme y vigoroso en todos los tratamientos. En el kale, los tallos mostraron un color crema uniforme y las hojas un verde intenso, con un crecimiento homogéneo en cada tratamiento. El análisis de Chi-cuadrado permitió identificar que las distribuciones de calidad visual de los microvegetales no registraron dependencia significativa respecto a los tratamientos bacterianos aplicados en ninguno de los dos cultivos evaluados (Figura 2b).
Figura 2. Distribución de la calidad visual de microvegetales de col morada (a) y kale (b) tratados con Bacillus spp. bajo condiciones controladas a los 15 días de la inoculación, Universidad Autónoma de Chihuahua, México, 2023.
Bt24 = B. thuringiensis. BsC4 = B. subtilis. BsPC = cepa comercial de B. subtilis QST713.
Figure 2. Distribution of visual quality of red cabbage (a) and kale (b) microgreens treated with Bacillus spp. under controlled environmental conditions at 15 days post-inoculation, Universidad Autónoma de Chihuahua, Mexico, 2023.
Bt24 = B. thuringiensis. BsC4 = B. subtilis. BsPC = commercial strain of B. subtilis QST713.
El análisis de la calidad visual de los microvegetales de col morada reveló que las categorías “Bueno” y “Excelente” fueron las de mayor frecuencia, mientras que las categorías de menor calidad (“Muy pobre”, “Pobre” y “Justa”) presentaron frecuencias nulas (Figura 2c). El tratamiento Bt24 y el control registraron un mayor frecuencia de microvegetales clasificados como “Excelente”, mientras que BsC4 y BsPC tuvieron una mayor frecuencia de microvegetales evaluados como “Bueno”. El análisis de Chi-cuadrado (X2 = 0,644) no mostró diferencias estadísticas significativas entre las distribuciones de la calidad visual de los tratamientos aplicados (p < 0,05). Estos resultados revelan que, aunque se hallaron diferencias numéricas entre los tratamientos, estas no fueron estadísticamente significativas, como se evidencia en la Figura 2a.
La distribución de las observaciones para los microvegetales de kale se concentró en las categorías “Bueno” y “Excelente”, con nulas frecuencias en las categorías de menor calidad (Figura 2b). El análisis de Chi-cuadrado resultó en un estadístico de X2 = 0,172, lo que indicó la ausencia de diferencias significativas entre los tratamientos bacterianos (p < 0,05). Las frecuencias observadas en los tratamientos Bt24 y el control presentaron una mayor frecuencia de microvegetales clasificados en la categoría “Excelente”, mientras que BsC4 y BsPC mostraron una distribución más homogénea entre las categorías “Bueno” y “Excelente”. Sin embargo, las diferencias numéricas no alcanzaron significancia estadística, como se representa en la Figura 2d.
Efecto de Bacillus sobre el rendimiento de los microvegetales
Los resultados del ANDEVA indicaron que el rendimiento de los microvegetales de col morada y kale, tras 15 días de tratamiento con Bacillus spp., presentaron diferencias estadísticas significativas (p < 0,05) (Figura 3).
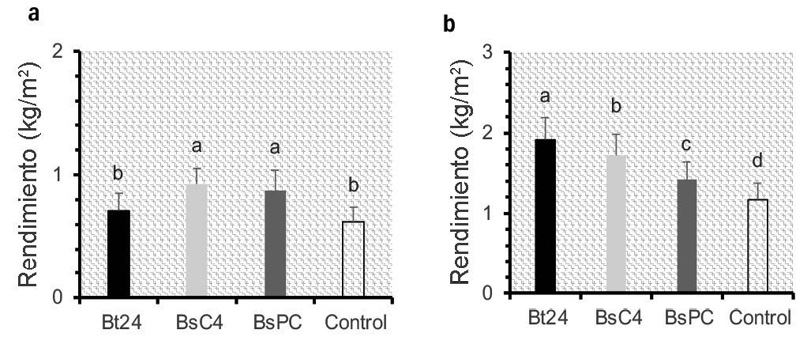
Figura 3. Rendimiento de microvegetales de col morada (a) y kale (b) tratados con microorganismos bajo condiciones controladas a los 15 días de la inoculación, Universidad Autónoma de Chihuahua, México, 2023.
Las líneas verticales representan la desviación estándar de las medias. Las barras con letras distintas indican diferencias estadísticas significativas a un p < 0,05 de acuerdo con la prueba de Tukey. Bt24 = B. thuringiensis. BsC4 = B. subtilis. BsPC = cepa comercial de B. subtilis QST713.
Figure 3. Yield of red cabbage (a) and kale (b) microgreens treated with microorganisms under controlled environmental conditions at 15 days post-inoculation, Universidad Autónoma de Chihuahua, Mexico, 2023.
Vertical lines represent the standard deviation of means. Bars with different letters indicate statistically significant differences at p < 0.05 according to Tukey’s test. Bt24 = B. thuringiensis. BsC4 = B. subtilis. BsPC = commercial strain of B. subtilis QST713.
En el caso de la col morada, los tratamientos BsC4 y BsPC presentaron los mejores rendimientos. Estos tuvieron un promedio de 0,900 kg/m2, lo que equivale a un incremento del 44,31 % en comparación con el tratamiento control, cuyo rendimiento fue de 0,624 kg/m2. El tratamiento Bt24 no mostró diferencias estadísticas significativas respecto al control, con una media de 0,707 kg/m2 (Figura 3a).
En kale, el tratamiento Bt24 registró el mejor rendimiento, con un promedio de 1,90 kg/m2, lo que representó un incremento del 62,60 % en comparación con el control. BsC4 alcanzó un rendimiento de 1,72 kg/m2, equivalente a un aumento del 46,42 %. Finalmente, en el tratamiento BsPC se observó una mejora del 21,37 % en el rendimiento, con un promedio de 1,42 kg/m2 (Figura 3b).
Discusión
Los resultados de este estudio mostraron que la inoculación de semillas de col morada con Bacillus spp. no tuvo un efecto significativo sobre los parámetros de germinación evaluados. Este hallazgo contrasta con estudios previos, como los de Aziz et al. (2012) y Ndeddy Aka y Babalola (2016), quienes reportaron aumentos significativos del 17,6 % al 30,0 % en la germinación de semillas de mostaza (Brassica juncea) inoculadas con diversas cepas de Bacillus. En contraste, en kale se encontraron variaciones significativas en la velocidad media de germinación y el tiempo medio de germinación. Lo anterior podría deberse a diferencias específicas entre especies de brásicas, en particular a propiedades estructurales de las semillas, ya que se observó que durante la imbibición la testa de kale se rompió antes que la de col morada, lo cual podría facilitar la colonización bacteriana.
El papel de Bacillus en la mejora de la germinación ha sido respaldado por estudios previos que destacan su capacidad para activar mecanismos bioquímicos y fisiológicos en las semillas (Li & Hu, 2020). Por ejemplo, B. subtilis QM3 aumenta la expresión y actividad de amilasas en trigo, acelerando el proceso de germinación (Hu et al., 2022). Además, componentes de la matriz extracelular de Bacillus, como proteínas capaces de interactuar con tejidos de almacenamiento, pueden inducir cambios en el metabolismo energético, como lo demostraron Berlanga-Clavero et al. (2021). Estas propiedades podrían explicar las diferencias observadas entre kale y col morada en este estudio, lo cual sugiere que las respuestas germinativas dependen tanto de la especie vegetal como de las características específicas de la cepa bacteriana.
En cuanto al desarrollo de los microvegetales, todas las variables morfológicas evaluadas fueron influenciadas por las cepas de Bacillus. El incremento en la altura y el diámetro del hipocótilo podría atribuirse a la producción de hormonas vegetales, como citoquininas y auxinas, por parte de estas bacterias, lo que estimula la división y expansión celular (Arkhipova et al., 2005; Blake et al., 2021; Etesami & Glick, 2024). Este efecto ha sido reportado en brásicas como la canola (Brassica napus), donde Bacillus mejoró significativamente parámetros morfológicos (Turan et al., 2014).
El aumento en el área cotiledonal, observado en particular con los tratamientos BsC4 y BsPC, sugiere un impacto en la capacidad fotosintética y el desarrollo inicial de las plántulas. Esto podría estar mediado por la producción de compuestos volátiles como 3-hidroxi-2-butanona y 2,3-butanodiol, que modulan la homeostasis hormonal y promueven un mayor crecimiento foliar (Iqbal et al., 2023; Ryu et al., 2003; Zhang et al., 2007). Este efecto confirma el papel de Bacillus como bioestimulante eficaz en las etapas tempranas del desarrollo de plántulas (Arif et al., 2021; Turan et al., 2014).
La biomasa fresca y la biomasa seca presentaron incrementos significativos con las cepas evaluadas, superando los valores reportados en investigaciones anteriores. Por ejemplo, B. cereus mejoró la biomasa fresca en un 26,74 % y la seca en un 36,17 % en plántulas de mostaza (Brassica rapa) (Akhtar et al., 2021). En este estudio, los aumentos alcanzaron hasta un 43,95 % en biomasa fresca y un 58,17 % en biomasa seca para col morada, con valores similares en kale. Estos resultados podrían estar relacionados con la capacidad de las bacterias para producir ACC desaminasa, reduciendo el etileno y favoreciendo el crecimiento foliar (Misra & Chauhan, 2020; Naing et al., 2021).
En cuanto al contenido de pigmentos fotosintéticos, se observaron efectos diferenciados según la especie vegetal y el tratamiento bacteriano. En col morada, el tratamiento BsC4 incrementó significativamente la clorofila b, mientras que en kale algunas cepas redujeron los niveles de clorofilas y carotenoides, posiblemente debido a la inducción de estrés fisiológico leve. Estas diferencias resaltan la importancia de las características específicas de cada especie en la interacción planta-microorganismo.
El contenido de nitratos, un parámetro clave de calidad nutricional, también fue influenciado significativamente por las cepas de Bacillus. Aunque el aumento en los nitratos puede ser beneficioso desde el punto de vista agronómico, es crucial garantizar que estos niveles se mantengan dentro de los límites seguros para el consumo humano (Luetic et al., 2023; Palmitessa et al., 2020). En este caso, los niveles observados no superaron los valores máximos permitidos por la Regulación 1258/2011 de la Unión Europea para otras especies de brásicas, cuyos niveles máximos están entre 6000 y 7000 mg NO3/kg de PF, lo que destaca el potencial de Bacillus para manejar de manera eficiente el metabolismo del nitrógeno en condiciones controladas.
En este estudio, las cepas de Bacillus no afectaron significativamente el índice de calidad de los microvegetales, lo cual es positivo en términos de mantener las características sensoriales y físicas de los microvegetales, atributos importantes para la aceptación por parte del consumidor (Caracciolo et al., 2020). Esto coincide con lo reportado por Lastochkina et al. (2019), quienes indicaron que bacterias del género Bacillus empleadas como promotoras del crecimiento o agentes de biocontrol en pre y poscosecha no afectan negativamente la calidad de los cultivos.
El rendimiento de los microvegetales se incrementó significativamente con BsC4 y Bt24, lo que sugiere que Bacillus pueden mejorar la productividad de estos cultivos emergentes. Sin embargo, aunque se dispone de información sobre su uso como bioestimulantes en sistemas convencionales o hidroponía, existe poca evidencia de su empleo en microvegetales (Galieni et al., 2020). Estudios previos, como el de Wang et al. (2024), han reportado mejoras en la germinación y la biomasa fresca con B. velezensis en microvegetales de chile, mientras que Eissa et al. (2018) han informado que B. megaterium en combinación con A. chroococcum y P. fluorescens mejoran el tamaño y el valor nutricional de brotes de chícharos. Por lo tanto, resulta relevante investigar cómo estas bacterias afectan la calidad y el contenido de nutrientes en especies como col morada, kale y otras brásicas cultivadas como microvegetales en condiciones controladas.
Conclusiones
Este estudio demostró que las cepas de Bacillus subtilis BsC4 y BsPC, así como Bacillus thuringiensis Bt24, tienen potencial como bioestimulantes en la producción de microvegetales de col morada y kale bajo condiciones controladas. Su aplicación mejoró significativamente diversas características morfológicas y de rendimiento, en particular la biomasa fresca y seca, y el área cotiledonar.
El efecto de las bacterias sobre el contenido de nitratos varió según la especie y el tratamiento, pero los valores observados se mantuvieron dentro de límites seguros establecidos por normativas internacionales. Esto respalda su posible uso en la producción comercial sin riesgos para la salud. Por otro lado, la influencia sobre el contenido de pigmentos fotosintéticos dependió de la interacción específica entre las cepas bacterianas y la especie vegetal, lo que sugiere la existencia de mecanismos diferenciados que requieren mayor investigación.
Los resultados destacan el potencial de Bacillus spp. como herramienta sostenible para optimizar la producción de microvegetales, y evidencian la necesidad de estudios complementarios que analicen su impacto en otros aspectos de calidad nutricional y fisiología.
Conflicto de intereses
Los autores declaran que no existe conflicto de intereses.
Referencias
Akhtar, N., Ilyas, N., Yasmin, H., Sayyed, R. Z., Hasnain, Z., Elsayed, A., & El Enshasy, H. A. (2021). Role of Bacillus cereus in improving the growth and phytoextractability of Brassica nigra (L.) K. Koch in chromium contaminated soil. Molecules, 26(6), Article 1569. https://doi.org/10.3390/molecules26061569
Alloggia, F. P., Bafumo, R. F., Ramirez, D. A., Maza, M. A., & Camargo, A. B. (2023). Brassicaceae microgreens: a novel and promissory source of sustainable bioactive compounds. Current Research in Food Science, 6, Article 100480. https://doi.org/10.1016/j.crfs.2023.100480
Al-Ansari, F., & Ksiksi, T. (2016). A quantitative assessment of gemination parameters: the case of Crotolaria persica and Tephrosia apollinea. The Open Ecology Journal, 9(1), 13–21.
Arif, S., Liaquat, F., Yang, S., Shah, I. H., Zhao, L., Xiong, X., Garcia, D., & Zhang, Y. (2021). Exogenous inoculation of endophytic bacterium Bacillus cereus suppresses clubroot (Plasmodiophora brassicae) occurrence in pak choi (Brassica campestris sp. chinensis L.). Plants, 253, Article 25. https://doi.org/10.1007/s00425-020-03546-4
Arkhipova, T. N., Veselov, S. U., Melentiev, A. I., Martynenko, E. V., & Kudoyarova, G. R. (2005). Ability of bacterium Bacillus subtilis to produce cytokinins and to influence the growth and endogenous hormone content of lettuce plants. Plant and Soil, 272, 201–209. https://doi.org/10.1007/s11104-004-5047-x
Aziz, Z. F. A., Saud, H. M., Rahim, K. A., & Ahmed, O. H. (2012). Variable responses on early development of shallot (Allium ascalonicum) and mustard (Brassica juncea) plants to Bacillus cereus inoculation. Malaysian Journal of Microbiology, 8(1), 47–50. http://dx.doi.org/10.21161/mjm.33711
Benincasa, P., Falcinelli, B., Lutts, S., Stagnari, F., & Galieni, A. (2019). Sprouted grains: A comprehensive review. Nutrients, 11(2), Article 421. https://doi.org/10.3390/nu11020421
Berlanga-Clavero, M. V., Molina-Santiago, C., Caraballo-Rodríguez, A. M., Petras, D., Díaz-Martínez, L., Pérez-García, A., De Vicente, A., Dorrestein, P. C., & Romero, D. (2021). Mutualistic interactions between B. subtilis and seeds dictate plant development. bioRxiv, Article 447311. https://doi.org/10.1101/2021.06.07.447311
Blake, C., Christensen, M. N., & Kovács, A. T. (2021). Molecular aspects of plant growth promotion and protection by Bacillus subtilis. Molecular Plant Microbe Interaction, 34(1), 15–25. https://doi.org/10.1094/MPMI-08-20-0225-CR
Caracciolo, F., El-Nakhel, C., Raimondo, M., Kyriacou, M. C., Cembalo, L., De Pascale, S., & Rouphael, Y. (2020). Sensory attributes and consumer acceptability of 12 microgreens species. Agronomy, 10(7), Article 1043. https://doi.org/10.3390/agronomy10071043
Cataldo, D. A., Maroon, M., Schrader, L. E., & Youngs, V. L. (1975). Rapid colorimetric determination of nitrate in plant tissue by nitration of salicylic acid. Communications in Soil Science and Plant Analysis, 6(1), 71–80. https://doi.org/10.1080/00103627509366547
Chandrasekaran, M., Belachew, S. T., Yoon, E., & Chun, S. C. (2017). Expression of β-1,3-glucanase (GLU) and phenylalanine ammonia-lyase (PAL) genes and their enzymes in tomato plants induced after treatment with Bacillus subtilis CBR05 against Xanthomonas campestris pv. vesicatoria. Journal of General Plant Pathology, 83, 7–13. https://doi.org/10.1007/s10327-016-0692-5
Da Silva Oliveira, C. E., Jalal, A., Vieira Aguilar, J., Santos de Camargos, L., Zoz, T., Ghaley, B. B., Abdel-Maksoud, M. A., Mohammed Alarjani, K., AbdElgawad, H., & Teixeira Filho, M. C. M. (2023). Yield, nutrition, and leaf gas exchange of lettuce plants in a hydroponic system in response to Bacillus subtilis inoculation. Frontiers in Plant Science, 14, Article 1248044. https://doi.org/10.3389/fpls.2023.1248044
Di Gioia, F., Renna, M., & Santamaria, P. (2017) Sprouts, microgreens and “Baby leaf” vegetables. In F. Yildiz, & R. C. Wiley (Eds.), Minimally processed refrigerated fruits and vegetables (pp. 403–432). Springer. https://doi.org/10.1007/978-1-4939-7018-6_11
Ebert, A. W. (2022). Sprouts and microgreens—Novel food sources for healthy diets. Plants, 11(4), Article 571. https://doi.org/10.3390/plants11040571
Eissa, N. H., Zayed, M. S., Hassanein, M. K., & Abdallah, M. M. F. (2018). Green pea sprout response to microbial inoculation and increasing atmospheric CO2 concentration. Arab Universities Journal Agriculture Sciences, 26(2D), 2513–2523. https://doi.org/10.21608/ajs.2018.35619
Etesami, H., & Glick, B. R. (2024). Bacterial indole-3-acetic acid: a key regulator for plant growth, plant-microbe interactions, and agricultural adaptive resilience. Microbiological Research, 281, Article 127602. https://doi.org/10.1016/j.micres.2024.127602
Fusari, C. M., Nazareno, M. A., Locatelli, D. A., Fontana, A., Beretta, V., & Camargo, A. B. (2020). Phytochemical profile and functionality of Brassicaceae species. Food Bioscience, 36, Article 100606. https://doi.org/10.1016/j.fbio.2020.100606
Galieni, A., Falcinelli, B., Stagnari, F., Datti, A., & Benincasa, P. (2020). Sprouts and microgreens: trends, opportunities, and horizons for novel research. Agronomy, 10(9), Article 1424. https://doi.org/10.3390/agronomy10091424
García, M., López, J. J., & Hidalgo, M. D. (1996). Análisis de datos categóricos. En J. Arnua (Coord.), Métodos y técnicas avanzadas de análisis de datos en ciencias del comportamiento (pp. 79–128). Unitat de Barcelona.
Ghosh, S., Bhattacharya, J., Nitnavare, R., & Webster, T. J. (2022). Heavy metal removal by Bacillus for sustainable agriculture. In M. T. Islam, M. Rahman, & P. Pandey. (Eds.), Bacilli in agrobiotechnology: Plant stress tolerance, bioremediation, and bioprospecting (pp. 1–30). Springer International Publishing. https://doi.org/10.1007/978-3-030-85465-2_1#DOI
González, H., & Fuentes, N. (2017). Mecanismo de acción de cinco microorganismos promotores de crecimiento vegetal. Revista de Ciencias Agrícolas, 34(1), 17–31. https://doi.org/10.22267/rcia.173401.60
Hernández-Valladares, N. L., Palemón-Alberto, F., Damián-Nava, A., Cruz-Lagunas, B., Herrera-Castro, N. D., Ortega-Acosta, S. Á., Toribio-Jiménez, J., & Reyes-García, G. (2021). Inoculación de bacterias promotoras de crecimiento vegetal y su efecto en ecotipos de tomate. Revista Fitotecnia Mexicana, 44(4), 581–589. https://doi.org/10.35196/rfm.2021.4.581
Hu, Q.-P., Guo, J., & Liu, J.-J. (2022). Wheat seed germination based on α-amylase activity to study promoting mechanism of Bacillus subtilis QM3. Journal of Seed Science, 44, e202244039. https://doi.org/10.1590/2317-1545v44263126
Ilangumaran, G., & Smith, D. L. (2017). Plant growth promoting rhizobacteria in amelioration of salinity stress: a systems biology perspective. Frontiers in Plant Science, 8, Article 1768. https://doi.org/10.3389/fpls.2017.01768
Iqbal, M., Naveed, M., Sanaullah, M., Brtnicky, M., Hussain, M. I., Kucerik, J., Holatko, J., & Mustafa, A. (2023). Plant microbe mediated enhancement in growth and yield of canola (Brassica napus L.) plant through auxin production and increased nutrient acquisition. Journal of Soils and Sediments, 23(3), 1233–1249. https://doi.org/10.1007/s11368-022-03386-7
Kanjanamaneesathian, M., Wiwattanapatapee, R., Rotniam, W., & Wongpetkhiew, W. (2014). Spraying hydroponic lettuce roots with a suspension concentrate formulation of Bacillus velezensis to suppress root rot disease and promote plant growth. New Zealand Plant Protection, 67, 213–219. https://doi.org/10.30843/nzpp.2014.67.5734
Katsenios, N., Christopoulos, N. V., Kakabouki, I., Vlachakis, D., Kavvadias, V., & Efthimiadou, A. (2021). Effect of pulsed electromagnetic field on growth, physiology and postharvest quality of kale (Brassica oleracea), wheat (Triticum durum) and spinach (Spinacia oleracea) microgreens. Agronomy, 11(7), Article 1364. https://doi.org/10.3390/agronomy11071364
Kyriacou, M. C., Rouphael, Y., Di Gioia, F., Kyratzis, A., Serio, F., Renna, M., De Pascale, S., & Santamaria, P. (2016). Micro-scale vegetable production and the rise of microgreens. Trends in Food Science & Technology, 57(A), 103–115. https://doi.org/10.1016/j.tifs.2016.09.005
Lastochkina, O., Seifikalhor, M., Aliniaeifard, S., Baymiev, A., Pusenkova, L., Garipova, S., Kulabuhova, D., & Maksimov, I. (2019). Bacillus spp.: efficient biotic strategy to control postharvest diseases of fruits and vegetables. Plants, 8(4), Article 97. https://doi.org/10.3390/plants8040097
Lee, J. S., Pill, W. G., Cobb, B. B., & Olszewski, M. (2004). Seed treatments to advance greenhouse establishment of beet and chard microgreens. The Journal of Horticultural Science and Biotechnology, 79(4), 565–570. https://doi.org/10.1080/14620316.2004.11511806
Li, Y.-J., & Hu, Q.-P. (2020). Studying of the promotion mechanism of Bacillus subtilis QM3 on wheat seed germination based on β-amylase. Open Life Science, 15(1), 553–560. https://doi.org/10.1515/biol-2020-0062
Li, T., Lalk, G. T., & Bi, G. (2021). Fertilization and pre-sowing seed soaking affect yield and mineral nutrients of ten microgreen species. Horticulturae, 7(2), Article 14. https://doi.org/10.3390/horticulturae7020014
Lichtenthaler, H. K., & Wellburn, A. R. (1983). Determinations of total carotenoids and chlorophylls a and b of leaf extracts in different solvents. Biochemical Society Transactions, 11(5), 591–592. https://doi.org/10.1042/bst0110591
Luetic, S., Knezovic, Z., Jurcic, K., Majic, Z., Tripkovic, K., & Sutlovic, D. (2023). Leafy vegetable nitrite and nitrate content: potential health effects. Foods, 12(8), Article 1655. https://doi.org/10.3390/foods12081655
Mir, S. A., Shah, M. A., & Mir, M. M. (2017). Microgreens: production, shelf life, and bioactive components. Critical Reviews in Food Science and Nutrition, 57(12), 2730–2736. https://doi.org/10.1080/10408398.2016.1144557
Misra, S., & Chauhan, P. S. (2020). ACC deaminase-producing rhizosphere competent Bacillus spp. mitigate salt stress and promote Zea mays growth by modulating ethylene metabolism. 3 Biotech, 10(3), Article 119. https://doi.org/10.1007/s13205-020-2104-y
Naing, A. H., Maung, T. T., & Kim, C. K. (2021). The ACC deaminase-producing plant growth-promoting bacteria: influences of bacterial strains and ACC deaminase activities in plant tolerance to abiotic stress. Physiologia Plantarum, 173(4), 1992–2012. https://doi.org/10.1111/ppl.13545
Ndeddy Aka, R. J., & Babalola, O. O. (2016). Effect of bacterial inoculation of strains of Pseudomonas aeruginosa, Alcaligenes faecalis and Bacillus subtilis on germination, growth, and heavy metal (Cd, Cr, and Ni) uptake of Brassica juncea. International Journal of Phytoremediation, 18(2), 200–209. https://doi.org/10.1080/15226514.2015.1073671
Palmitessa, O. D., Renna, M., Crupi, P., Lovece, A., Corbo, F., & Santamaria, P. (2020). Yield and quality characteristics of Brassica microgreens as affected by the NH4: NO3 molar ratio and strength of the nutrient solution. Foods, 9(5), Article 677. https://doi.org/10.3390/foods9050677
Paradiso, V. M., Castellino, M., Renna, M., Gattullo, C. E., Calasso, M., Terzano, R., Allegretta, I., Leoni, B., Caponio, F., & Santamaria, P. (2018). Nutritional Characterization and shelf-life of packaged microgreens. Food & Function, 9(11), 5629–5640. https://doi.org/10.1039/C8FO01182F
Ramirez, D., Abellán-Victorio, A., Beretta, V., Camargo, A., & Moreno, D. A. (2020). Functional ingredients from Brassicaceae species: overview and perspectives. International Journal of Molecular Science, 29(6), Article 1998. https://doi.org/10.3390/ijms21061998
Ranal, M. A., & Garcia de Santana, D. (2006). How and why to measure the germination process? Brazilian Journal of Botany, 29(1), 1–11. https://doi.org/10.1590/S0100-84042006000100002
Rennie, T. J., Vigneault, C., Raghavan, G. S. V., & DeEll, J. R. (2001). Effect of pressure reduction rate on vacuum cooled lettuce quality during storage. Canadian Biosystems Engineering, 43(3), 39–43. https://www.library.csbe-scgab.ca/all-publications/2439:effects-of-pressure-reduction-rate-on-vacuum-cooled-lettuce-quality-during-storage
Ryu, C.-M., Farag, M. A., Hu, C.-H., Reddy, M. S., Wei, H.-X., Paré, P. W., & Kloepper, J. W. (2003). Bacterial volatiles promote growth in Arabidopsis. Proceedings of the National Academy of Sciences, 100(8), 4927–4932. https://doi.org/10.1073/pnas.0730845100
Saengha, W., Karirat, T., Buranrat, B., Matra, K., Deeseenthum, S., Katisart, T., & Luang-In, V. (2021). Cold plasma treatment on mustard green seeds and its effect on growth, isothiocyanates, antioxidant activity and anticancer activity of microgreens. International Journal of Agriculture and Biology, 25, 667–676.
Santoyo, G., Guzmán-Guzmán, P., Parra-Cota, F. I., De los Santos-Villalobos, S., Orozco-Mosqueda, M. del C., & Glick, B. R. (2021). Plant growth stimulation by microbial consortia. Agronomy, 11(2), Article 219. https://doi.org/10.3390/agronomy11020219
Tan, L., Nuffer, H., Feng, J., Kwan, S. H., Chen, H., Tong, X., & Kong, L. (2020). Antioxidant properties and sensory evaluation of microgreens from commercial and local farms. Food Science and Human Wellness, 9(1), 45–51. https://doi.org/10.1016/j.fshw.2019.12.002
The Jamovi Projet. (s. f.). Jamovi. Versión 2.5.2.0. https://www.jamovi.org
Trujillo Peralta, F. A., López Avilés, G., Mondragón Camarillo, L., & Calderón, K. (2023). Bacterias tolerantes y resistentes a los metales pesados en el ambiente. Epistemus (Sonora), 17(35), 80–87. https://epistemus.unison.mx/index.php/epistemus/article/view/287
Tsotetsi, T., Nephali, L., Malebe, M., & Tugizimana, F. (2022). Bacillus for plant growth promotion and stress resilience: what have we learned? Plants, 11(19), Article 2482. https://doi.org/10.3390/plants11192482
Turan, M., Ekinci, M., Yildirim, E., Günes, A., Karagöz, K., Kotan, R., & Dursun, A. (2014). Plant growth-promoting rhizobacteria improved growth, nutrient, and hormone content of cabbage (Brassica oleracea) seedlings. Turkish Journal of Agriculture and Forestry, 38(3), 327–333. https://doi.org/10.3906/tar-1308-62
Vela-Corcia, D., Hierrezuelo, J., Pérez-Lorente, A. I., Stincone, P., Pakkir Shah, A. K., Grélard, A., Zi-Long, Y., De Vicente, A., Pérez García, A., Bai, L., Loquet, A., Petras, D., & Romero, D. (2024). Cyclo(Pro-Tyr) elicits conserved cellular damage in fungi by targeting the [H+]ATPase Pma1 in plasma membrane domains. Communications Biology, 7(1), Article 1253. https://doi.org/10.1038/s42003-024-06947-3
Waguespack, E., Bush, E., & Fontenot, K. (2022). The effect of organic biostimulants on beneficial soil microorganism activity. Open Journal of Ecology, 12(8), 499–512. https://doi.org/10.4236/oje.2022.128027
Wan, M. W. M. A., Naing, N. N., & Abd, N. N. (2008). An application of box-cox transformation to biostatistics experiment data. Journal of Bioscience, 19(1), 137–145.
Wang, R., Li., B., Jin, T., Weng, Q., & Liu, P. (2024). Bacillus velezensis stimulated the absorption of iodine to improve antioxidants and delay post-harvest senescence in microgreens. LWT, 197, Article 115898. https://doi.org/10.1016/j.lwt.2024.115898
Wardle, D. A., Ahmed, M., & Nicholson, K. S. (1991). Allelopathic influence of nodding thistle (Carduus nutans L.) seeds on germination and radicle growth of pasture plants. New Zealand Journal of Agricultural Research, 34(2), 185–191. https://doi.org/10.1080/00288233.1991.10423358
Weinand, T., El-Hasan, A., & Asch, F. (2023). Role of Bacillus spp. plant growth promoting properties in mitigating biotic and abiotic stresses in lowland rice (Oryza sativa L.). Microorganisms, 11(9), Article 2327. https://doi.org/10.3390/microorganisms11092327
Xiao, Z., Rausch, S. R., Luo, Y., Sun, J., Yu, L., Wang, Q., Chen, P., Yu, L., & Stommel, J. R. (2019). Microgreens of Brassicaceae: genetic diversity of phytochemical concentrations and antioxidant capacity. LWT, 101, 731–737. https://doi.org/10.1016/j.lwt.2018.10.076
Zhang, H., Kim, M.-S., Krishnamachari, V., Payton, P., Sun, Y., Grimson, M., Farag, M. A., Ryu, C.-M., Allen, R., Melo, I. S., & Paré, P. W. (2007). Rhizobacterial volatile emissions regulate auxin homeostasis and cell expansion in Arabidopsis. Plants, 226, 839–851. https://doi.org/10.1007/s00425-007-0530-2

Esta obra está bajo una licencia de Creative Commons Reconocimiento-NoComercial-SinObraDerivada 4.0 Internacional.
Puede hallar permisos más allá de los concedidos con esta licencia en pccmca@gmail.com