Actividad antifúngica de Bacillus amyloliquefaciens contra Fusarium oxysporum f. sp. cubense raza 1
DOI:
https://doi.org/10.15517/am.v32i2.39720Palabras clave:
antagonista, control biológico, marchitez por Fusarium, metabolitosResumen
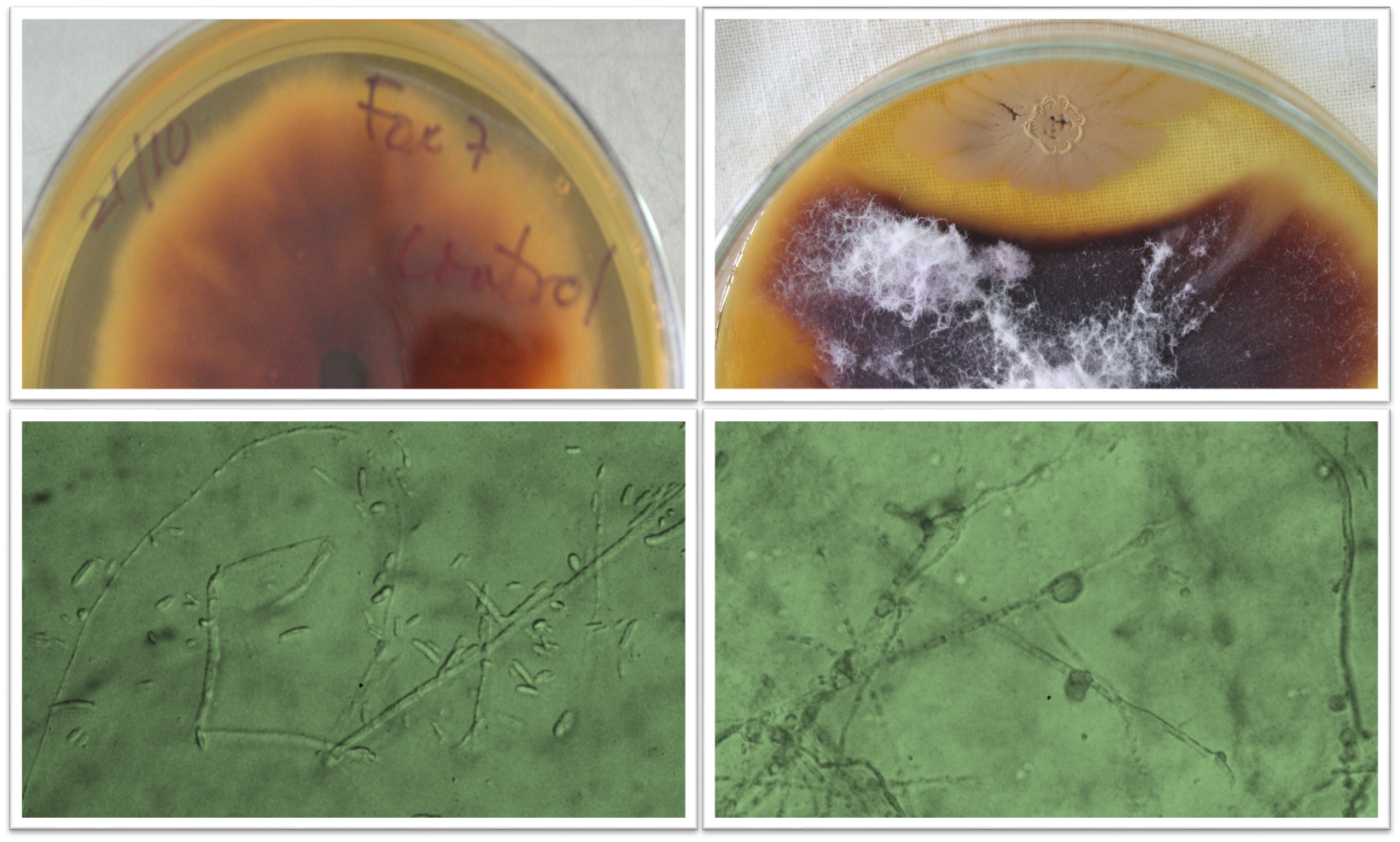
Introdución. Debido a la ausencia de agentes químicos totalmente efectivos o económicamente viables para el control del marchitamiento por Fusarium, el uso de microorganismos antagonistas es de gran interés ya que podría representar una alternativa más sostenible desde el punto de vista económico y ecológico. Objetivo. Analizar del efecto antifúngico de la cepa Bacillus amyloliquefaciens CCIBP-A5 contra Fusarium oxysporum. Materiales y métodos. El trabajo se realizó en el laboratorio de Microbiología Aplicada del Instituto de Biotecnología de las Plantas, en Cuba, entre septiembre 2017 y junio 2018. Se analizó la actividad antifúngica in vitro e in vivo de las células y su filtrado de cultivo frente a F. oxysporum. Resultados. Los metabolitos presentes en el filtrado de cultivo de B. amyloliquefaciens CCIBP-A5 influyeron significativamente en el crecimiento y la morfología del micelio y los conidios. También causaron daño oxidativo en las moléculas de lípidos de F. oxysporum. Además, esta cepa mostró efectos inhibitorios sobre el desarrollo del patógeno en condiciones controladas. Estos aspectos son clave cuando se selecciona un candidato bacteriano como agente de control biológico. Conclusiones. Los resultados mostraron que la cepa de B. amyloliquefaciens CCIBP-A5, aislada de Musa sp., tuvo un efecto antifúngico in vitro contra las estructuras vegetativas y de reproducción de Foc raza 1, así como en la interacción Musa spp. - F. oxysporum. Esta cepa se propone para el desarrollo de un bioproducto para el manejo de la marchitez por Fusarium.
Descargas
Citas
Abdallah, A. B., Jabnoun-Khiareddine, R. H., Mokni-Tlili, S., Nefzi, A., Medimagh-Saidana, S., & Daami-Remadi, M. (2015). Endophytic Bacillus spp. from wild Solanaceae and their antifungal potential against Fusarium oxysporum f. sp. lycopersici elucidated using whole cells, filtrate cultures and organic extracts. Journal of Plant Pathology and Microbiology, 6, 324-330. https://doi.org/10.4172/2157-7471.1000324
Abdallah, A. B., Stedel, C., Garagounis, C., Nefzi, A., Jabnoun-Khiareddine, H., Papadopoulou, K. K., & Daami-Remadi, M. (2017). Involvement of lipopeptide antibiotics and chitinase genes and induction of host defense in suppression of Fusarium wilt by endophytic Bacillus spp. in tomato. Crop Protection, 99, 45-58. https://doi.org/10.1016/j.cropro.2017.05.008
Anthony, K. K., George, D. S., Baldev Singh, H. K., Fung, S. M., Santhirasegaram, V., Razali, Z., & Somasundram, C. (2017). Reactive oxygen species. Activity and antioxidant properties of Fusarium infected bananas. Journal of Phytopathology, 165(4), 213-222. https://doi.org/10.1111/jph.12552
Ayala, A., Muñoz, M., & Argüelles, S. (2014). Lipid Peroxidation: Production, metabolism, and signaling mechanisms of malondialdehyde and 4-Hydroxy-2Nonenal. Oxidative Medicine and Cellular Longevity, 2014, Article e360438. https://doi.org/10.1155/2014/360438
Bacon, C.W., & Hinton, D.M. (2011). Bacillus mojavensis: its endophytic nature, the surfactins, and their role in the plant response to infection by Fusarium verticillioides. In D.K. Maheshwari (Ed.), Bacteria in agrobiology: Plant growth responses (pp. 21-39). Springer-Verlag.
Broekaert, W.F, Terras, F., Cammue, B., & Vanderleyden, J. (1990). An automated quantitative assay for fungal growth inhibition. FEMS Microbiology Letters, 69, 55-69. https://doi.org/10.1111/j.1574-6968.1990.tb04174.x
Choi, G., Jae Lee, H., & Yun-Cho, K. (1996). Lipid peroxidation and membrane disruption by vinclozolin in dicarboximidesusceptible and resistat isolates of Botrytis cinerea. Pesticide Biochemestry and Physiology, 55(1), 29-39. https://doi.org/10.1006/pest.1996.0032
Chowdhury, S.P., Hartmann, A., Gao, X., & Borriss, R. (2015). Biocontrol mechanism by root-associated Bacillus
amyloliquefaciens FZB42 a review. Frontiers in Microbiology, 6, Article 780. https://doi.org/10.3389/fmicb.2015.00780
Cong, L.L., Sun Y., Wang, J.M., Kang, T.J., Zhang, B., Biligetu, B., & Yang, Q.C. (2017). A rapid screening method for evaluating resistance of alfalfa (Mendicago sativa L.) to Fusarium root rot. Canadian Journal of Plant Pathology, 40, 1-22. https://doi.org/10.1080/07060661.2017.1402822
Cruz-Martín, M., Acosta-Suárez, M., Mena, E., Roque, B., Leiva-Mora, M., Pichardo, T., del Pilar-Castro, R., & Alvarado-Capó, Y. (2013). Cuantificación del crecimiento in vitro de Mycosphaerella fijiensis mediante lecturas de absorbancia. Biotecnología Vegetal, 13(4), 219-224.
Dita-Rodríguez, M., Echegoyen-Ramos, P., & Pérez-Vicente, L. (2013). Plan de contingencia ante un brote de la raza 4 tropical de Fusarium oxysporum f. sp. cubense en un país de la región del OIRSA. Organismo Internacional Regional de Sanidad Agropecuaria. https://www.ippc.int/sites/default/files/documents/20130812/plandecontingenciacontrafocr4toirsa_2013081213%3A52--6.59%20MB.pdf
Dita, M. A., Pérez-Vicente, L., & Martínez, E. (2014). Inoculation of Fusarium oxysporum f. sp. cubense causal agent of Fusarium wilt in banana. In L. F. Pérez-Vicente, M. Dita, E. Martinez de la Parte (Eds.), Technical manual prevention and diagnostic of Fusarium wilt (Panama disease) of banana caused by Fusarium oxysporum f. sp. cubense Tropical Race 4 (TR4) (pp. 55-58). Food and Agriculture Organization.
Fan, H., Zhang, Z., Li, Y., Zhang, X., Duan, Y., & Wang, Q. (2017). Biocontrol of bacterial fruit blotch by Bacillus subtilis 9407 via surfactin-mediated antibacterial activity and colonization. Frontiers in Microbiology, 8, Article 1973. https://doi.org/10.3389/fmicb.2017.01973
Gang, G., Bizun, W., Weihong, M., Xiaofen, L., Xiaolin, Y., Chaohua, Z., Jianhong, M., & Huicai, Z. (2013). Review: Biocontrol of Fusarium wilt of banana: Key influence factors and strategies. African Journal of Microbiology Research, 7, 4835-4843. https://doi.org/10.5897/AJMR2012.2392
Gond, S. K., Marshall, S. B., Torresa, M. S., & White, J. J. (2015). Endophytic Bacillus spp. produce antifungal lipopeptides and induce host defense gene expression in maize. Microbiology Research, 172, 79-87. https://doi.org/.1016/j.micres.2014.11.004
Hernández-Castillo, F., Lira-Saldivar, R.H., Cruz-Chávez, L., Gallegos-Morales, G., Galindo-Cepeda, M., Padrón, E., & Hernández-Suárez, M. (2008). Potencial antifúngico de cepas de Bacillus spp. y extracto de Larrea tridentata contra Rhizoctonia solani en el cultivo de la papa (Solanum tuberosum L.). ÖYTON, 77, 241-252.
Ho, Y. N., Chiang, H. M., Chao, C. P., Su, C. C., Hsu, H. F., Guo, C., Hsieh, J. L., & Huang, C. C. (2015). In planta biocontrol of soilborne Fusarium Wilt of banana through a plant endophytic bacterium, Burkholderia cenocepacia 869T2. Plant Soil, 387, 295-306. https://doi.org/10.1007/s11104-014-2297-0
Huang, Y. H., Wang, R. C., Li, C. H., Zuo, C. W., Wei, Y. R., Zhang, L., & Yi, G. J. (2012). Control of Fusarium wilt in banana with Chinese leek. European Journal of Plant Pathology, 134, 87-95. https://doi.org/10.1007/s10658-012-0024-3
Krieg, N. R., & Holt, J. (1984). Bergey’s manual of systematic bacteriology (9th Ed.) Williams & Wilkins.
Lane, D. (1991). 16S/23S rRNA sequencing. In E. Stackebrandt, & M. Goodfellow (Eds.), Nucleic acid techniques in bacterial systematics (pp. 115-175). John Wiley & Sons, Inc.
Lee, T., Park, D., Kim, K., Lim, S. M., Yu, N. H., Kim, S., Kim, H. Y., Jung, K. S., Jang, J. Y., Park, J. C., Ham, H., Lee, S., Hong, S. K., & Kim, J. C. (2017). Characterization of Bacillus amyloliquefaciens DA12 showing potent antifungal activity against mycotoxigenic Fusarium species. Plant Pathology, 3, 499-507. https://doi.org/10.5423/PPJ.FT.06.2017.0126
Leyva, L., Cruz-Martín, M., Acosta-Suárez, M., Pichardo, T., Bermúdez-Caraballoso, I., & Alvarado-Capó, Y. (2017). In vitro antagonist of Bacillus spp. strains against Fusarium oxysporum f. sp. cubense. Biotecnología Vegetal, 17(4), 229-236.
Li, L., Ma, M., Huang, R., Qu, Q., Li, G., Zhou, J., Zhang, Q., Lu, K., Niu, X., & Luo, J. (2012). Induction of chlamydospore formation in Fusarium by cyclic lipopeptide antibiotics from Bacillus subtilis C2. Journal of Chemistry and Ecology, 38, 966-974. https://doi.org/10.1007/s10886-012-0171-1
Li, L., Qu, Q., Tian B. Y., & Zhang, K. Q. (2005). Induction of chlamydospores in Trichoderma harzianum and Glioladium roseum by antifungal compounds produced by Bacillus subtilis C2. Journal of Phytopathology, 153, 868-693. https://doi.org/10.1111/j.1439-0434.2005.01038.x
Liao, J. H., Chen, P. Y., Yang, Y. L., Kan, S. C., Hsieh, F. C., & Liu, Y. C. (2016). Clarification of the antagonistic effect of the lipopeptides produced by Bacillus amyloliquefaciens BPD1 against Pyricularia oryzae via in situ MALDI-TOF IMS analysis. Molecules, 21, Article 1670. https://doi.org/10.3390/molecules21121670
Liu, K., Newman, M., McInroy, J. A., Hu, C. H., & Kloepper, J. W. (2017). Selection and assessment of plant growth-promoting rhizobacteria for biological control of multiple plant diseases. Phytopathology, 107(8), 928-937. https://dx.doi.org/10.1094/PHYTO-02-17-0051-R
Ng, L. C., Sariah, M., Sariam, O., Radziah, O., & Abidin, M. A. Z. (2016). PGPM-induced defense-related enzymes in aerobic rice against rice leaf blast caused by Pyricularia oryzae. European Journal of Plant Pathology, 145, Article 167. https://dx.doi.org/10.1007/s10658-015-0826-1
Nourozian, J., Etebarian, H. R., & Khodakaramian, G. (2006). Biological control of Fusarium graminearum on wheat by antagonistic bacteria. Songklanakarin Journal of Science and Technology, 28, 29-38.
Pérez-Vicente, L. (2016, April 19-22). Banana farm best practices for prevention of Fusarium wilt TR4 and other exotic banana diseases [Conference presentation]. XXI International ACORBAT Meeting, Miami, FL, USA. https://www.musalit.org/seeMore.php?id=18309
Pérez-Vicente, L., & Dita, M. A. (2014). Fusarium wilt of banana or panama disease by Fusarium oxysporum f. sp. cubense: A review on history, symptoms, biology, epidemiology and management. In L. F. Pérez-Vicente, M. Dita, E. Martinez de la Parte (Eds.), Technical manual prevention and diagnostic of Fusarium wilt (Panama disease) of banana caused by Fusarium oxysporum f. sp. cubense Tropical Race 4 (TR4) (pp. 5-30). Food and Agriculture Organization.
Ploetz, R. C. (2015a). Fusarium wilt of banana. Phytopathology, 105, 1512-1521. http://doi.org/10.1094/PHYTO-04-15-0101-RVW
Ploetz, R. C. (2015b). Management of Fusarium wilt of banana: A review with special reference to tropical race 4. Crop Protection, 73, 7-15. https://doi.org/10.1016/j.cropro.2015.01.007
Radhakrishnan, R., Hashem, A., & Abd-Allah, E.F. (2017). Bacillus: A biological tool for crop improvement through biomolecular changes in adverse environments. Frontiers in Physiology, 8, Article 667. https://doi.org/10.3389/fphys.2017.00667
Raza, W., Ling, N., Yang, L., Huang, Q., & Shen, Q. (2016). Response of tomato wilt pathogen Ralstonia solanacearum to the volatile organic compounds produced by a biocontrol strain Bacillus amyloliquefaciens SQR-9. Scientific Reports, 6, Article 24856. https://doi.org/10.1038/srep24856
Rojas-Solís, D., Contreras-Pérez, M., & Santoyo, G. (2013). Mecanismos de estimulación del crecimiento vegetal en bacterias del género Bacillus. Biológicas, 15(2), 36-41.
Sekhar, A. C., & Thomas, P. (2015). Isolation and identification of shoot-tip associated endophytic bacteria from banana cv. Grand Naine and testing for antagonistic activity against Fusarium oxysporum f. sp. cubense. American Journal of Plant Science, 6, 943-954. https://doi.org/10.4236/ajps.2015.67101
Simonetti, E., Roberts, I. N., Montecchia, M. S., Gutierrez-Boem, F. H., Gomez, F. M., & Ruiz, J. A. (2018). A novel
Burkholderia ambifaria strain able to degrade the mycotoxin fusaric acid and to inhibit Fusarium. Microbiology Research, 206, 50-59. https://doi.org/10.1016/j.micres.2017.09.008
Srivastava, S., Bist, V., Srivastava, S., Singh, P. C., Trivedi, P. K., Asif, M. H., Chauhan, P. S., & Nautiyal, C. S. (2016). Unraveling aspects of Bacillus amyloliquefaciens mediated enhanced production of rice under biotic stress of Rhizoctonia solani. Frontiers in Plant Science, 7, Article 587. https://doi.org/10.3389/fpls.2016.00587
Stover, R. H., & Simmonds N. W. (1987). Bananas (3rd Ed.). Longmans.
Tang, Q., Bie, X., Lu, Z., Lv, F., Tao, Y., & Qu, X. (2014). Effects of fengycin from Bacillus subtilis fmbJ on apoptosis and necrosis in Rhizopus stolonifer. Journal of Microbiology, 2, 675-680. https://doi.org/10.1007/s12275-014-3605-3
Wang, C., Xing, J., Chin, C. K., & Peters, J. S. (2002). Fatty acids with certain structural characteristics are potent inhibitors of germination and inducers of cell death of powdery mildew. Physiology and Molecular Plant Pathology, 61, 151-161. https://doi.org/10.1006/pmpp.2002.0429
Wu, B., Wang, X., Yang, L., Yang, H., Zeng, H., Qiu, Y., & He, Z. (2016). Effects of Bacillus amyloliquefaciens ZM9 on bacterial wilt and rhizosphere microbial communities of tobacco. Applied Soil Ecology, 103, 1-12. https://doi.org/10.1016/j.apsoil.2016.03.002
Wiyono, H., & Widono, S. (2013). Vigor of plantlet from microplantlet treated by filtrate and cell suspension of some isolates of Bacillus and resistance to banana wilt pathogen after acclimatization. ESci Journal of Plant Pathology, 2(2), 70-75.
Xue, C., Penton, C. R., Shen, Z., Zhang, R., Huang, Q., Li, R., Ruan, Y., & Shen, Q. (2015). Manipulating the banana rhizosphere microbiome for biological control of Panama disease. Science Report, 5, Article 11124. https://doi.org/10.1038/srep11124
Yin, H., Xu, L., & Porter, N. (2011). Free radical lipid peroxidation: mechanisms and analysis. Chemical Reviews, 111(10), 5944-5972. https://doi.org/10.1021/cr200084z
Zacky, F. A., & Tiny, S. Y. (2013). Investigating the bioactivity of cells and cell-free extracts of Streptomyces. Biological Control, 66, 204-208. https://doi.org/10.1016/j.biocontrol.2013.06.001
Descargas
Archivos adicionales
Publicado
Cómo citar
Número
Sección
Licencia
1. Política propuesta para revistas de acceso abierto
Los autores/as que publiquen en esta revista aceptan las siguientes condiciones:
- Los autores/as conservan los derechos morales de autor y ceden a la revista el derecho de la primera publicación, con el trabajo registrado con la licencia de atribución, no comercial y sin obra derivada de Creative Commons, que permite a terceros utilizar lo publicado siempre que mencionen la autoría del trabajo y a la primera publicación en esta revista, no se puede hacer uso de la obra con propósitos comerciales y no se puede utilizar las publicaciones para remezclar, transformar o crear otra obra.
- Los autores/as pueden realizar otros acuerdos contractuales independientes y adicionales para la distribución no exclusiva de la versión del artículo publicado en esta revista (p. ej., incluirlo en un repositorio institucional o publicarlo en un libro) siempre que indiquen claramente que el trabajo se publicó por primera vez en esta revista.
- Se permite y recomienda a los autores/as a publicar su trabajo en Internet (por ejemplo en páginas institucionales o personales) antes y durante el proceso de revisión y publicación, ya que puede conducir a intercambios productivos y a una mayor y más rápida difusión del trabajo publicado (vea The Effect of Open Access).



























